2017-10-19 | 投射腹侧苍白球区的D1和D2-MSN在可卡因成瘾中的不同作用
报告人: Yonatan Kupchik
整理人:王媛
审核人:周专
2017年10月19日下午,以色列希伯来大学(The Hebrew University of Jerusalem)神经生物学研究所的Yonatan Kupchik教授受邀来到北京大学,参与北京大学麦戈文脑研究所与以色列Edmond和Lili Safra脑科学中心共同组织的脑科学研讨会,在王克桢楼1113会议室为大家带来了一场报告:投射腹侧苍白球区的D1和D2-MSN在可卡因成瘾中的不同作用/Differential roles for D1-MSN and D2-MSN terminals in the ventral pallidum in promoting cocaine seeking。Yonatan Kupchik教授的主要研究方向是伏隔核(nucleus accumbens, NAc)区域(也称腹侧纹状体)在可卡因成瘾中的作用。在本场讲座中,Yonatan Kupchik教授介绍了其实验室的最新研究成果,即腹侧纹状体的D1-MSNs和D2-MSNs均投射到腹侧苍白球区,并在可卡因成瘾过程中起不同的作用。
概述
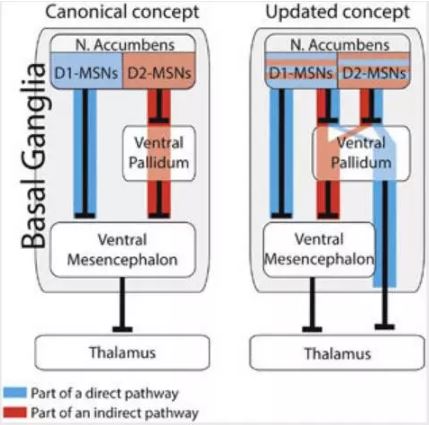
腹侧纹状体是控制奖赏的区域,在药物成瘾过程中起重要作用。腹侧纹状体的神经元接受来自腹侧被盖区(Ventral tegmental area, VTA)多巴胺能神经元的投射。腹侧纹状体区域95%的神经元是多棘神经元,分为D1激活型多巴胺受体的纹状体多棘神经元(D1-expressing medium spiny neurons, D1-MSNs)和D2抑制型多巴胺受体的纹状体多棘神经元(D2-expressing medium spiny neurons, D2-MSNs)。之前的研究认为腹侧纹状体通过两条途径投射到到腹侧中脑ventral mesencephalon (VM),VM投射到丘脑,丘脑再作用于大脑皮层进而控制行为。其中一条途径为直接途径:D1-MSNs直接投射到VM区;另一条途径为间接途径, 即D2-MSNs先投射到腹侧苍白球ventral pallidum (VP), VP区再投射到VM区。
Kupchik教授表示D2-MSNs到VP区之后也可以不经过VM区,而直接投射到丘脑。此外,他们发现D1-MSNs也可以投射到VP区,通过间接途径控制VM区,再到丘脑。因此腹侧纹状体并不是通过D1-MSNs直接形式和D2-MSN间接形式这两种简单的神经环路控制奖赏,而是D1-和D2-MSNs都有直接和间接的途径对丘脑进行控制。并且他们还发现在可卡因成瘾过程中,投射到VP区的D1-MSNs促进复吸的行为,而投射到VP区的D2-MSNs则抑制复吸反应。
经典D1-MSN直接途径和D2-MSN间接途径简介
腹侧纹状体控制奖赏的经典神经环路分为D1-MSNs直接途径和D2-MSNs间接途径。D1和D2-MSNs均为抑制型神经元,分泌γ-氨基丁酸。VP区也是分泌γ-氨基丁酸的抑制型神经元。而VM区为兴奋型神经元,分泌谷氨酸。D1-MSNs直接途径为D1-MSNs通过分泌γ-氨基丁酸,作用于VM区,抑制VM区的神经活动,进而抑制丘脑区的神经元,丘脑区域的抑制导致运动的下降。而在间接途径中,D2-MSNs通过分泌γ-氨基丁酸,抑制VP区的抑制型神经元, VP区再投射到VM区,D2-MSNs去抑制掉VP区的作用,使得VM区的神经活动增强,最终运动增强。
图一
研究方法
成瘾行为学范式
自身给药并戒断是药物成瘾研究中经常用到的技术。在自身给药训练中,他们采用颈外静脉注射作为给药途径。小鼠压杆后,信号转换器将信号传入计算机,计算机通过软件设定的程序将信号指令传出至注射泵,并将药物注入到小鼠体内,同时灯光作为一种关联信号,使小鼠建立条件反射。在此程序下,进行自身给药训练,建立可卡因成瘾模型。模型建立后,进入至少10天的戒断训练,用生理盐水替代可卡因,也不再给予灯光偶联,所有小鼠在自身给药箱中进行可卡因成瘾消退训练。戒断完成后,给予灯光条件诱导,测试复吸行为。
化学遗传
他们结合化学遗传学和Cre-loxp技术特定激活或抑制D1或D2-MSNs。化学遗传学是指配体叠氮平-N-氧化物(clozapine-N-oxide, CNO)结合特定药物激活的受体(designer receptors exclusively activated by designer drugs, DREADDs),进而影响神经元的活动。具体来说CNO可以作为诱导剂,激活DREADDs受体。CNO激活的DREADDs,会选择性地作用于不同的GPCR级联反应,从而激活或抑制神经元活动的反应。利用DIO(double-floxed inverted open reading frame)病毒载体实现在表达Cre的细胞群体上特异性表达受体DREADDs。他们将激活型DIO-Gs(rM3D)-DREADD和抑制型DIO-Gi(hM4D)-DREADD分别注射到D1-Cre转基因老鼠和D2-Cre转基因老鼠大脑腹侧纹状体。在小鼠完成可卡因成瘾和戒断之后,复吸测试当天给予配体CNO诱导,分别特定地激活或抑制D1和D2-MSNs。
光遗传
光遗传是指结利用光刺激精确控制特定神经元活动的技术。在特定脑区表达光敏感通道蛋白(channelrhodopsin, ChR), 给予特定波段光的激发,诱导ChR的激活,促使神经元细胞膜去极化,从而激活神经元。他们同样利用D1-Cre和D2-Cre转基因老鼠,将ChR病毒注射到腹侧纹状体,使腹侧纹状体区域D1-MSNs或D2-MSNs特定表达ChR,这样在给予光刺激腹侧纹状体时,特异激活D1-MSNs或D2-MSNs。
实验结果
D1-MSN和D2-MSN均投射到VP区,并在可卡因复吸过程中起相反作用
Kupchik教授表示当特定激活投射VP区的D1-MSNs后,小鼠的复吸行为增加,并且同时抑制VP区域神经元,小鼠复吸行为又会回复到正常水平。而特定抑制投射VP区的D2-MSNs后,小鼠复吸行为增加,同时抑制VP区域神经元,小鼠复吸行为会回复到正常水平。这表明D1-MSNs投射到VP区可以增强可卡因复吸行为,而D2-MSNs投射到VP区可以抑制可卡因复吸行为。
图二
可卡因使D2-MSN对VP区的控制减弱
D1和D2-MSNs对VP区控制可卡因复吸的过程中起到相反的作用,那么D1和D2-MSNs一起是怎样起作用的呢?为了解决这个问题,他们将ChR病毒注射到D1或D2-Cre转基因老鼠腹侧纹状体,在VP区域给予光刺激特定激活D1-MSNs或D2-MSNs的神经末梢,在VP神经元上记录到由光刺激D1和D2-MSN引起的抑制性突触后电流(evoked inhibitory postsynaptic current, eIPSC)。通过局部施加高频电刺激可以诱发VP神经元分别来自D1-MSNs和D2-MSNs的长时程抑制效应(long term depression, LTD)。他们发现,在可卡因成瘾的小鼠上,D2-MSNs的LTD效应同对照小鼠相比明显减弱,而D1-MSNs的LTD效果不变。根据这个结果,Kupchik教授提出假设:在正常情况下D1和D2-MSNs分别促进和抑制可卡因复吸行为,而D2-MSNs的抑制效果显著,使老鼠不会产生觅药行为;在可卡因成瘾的老鼠中,D2-MSNs的作用减弱,不足以抵抗D1-MSNs的影响,导致老鼠更容易复吸。
图三
可卡因复吸可能与阿片受体或强啡肽(Dynorphin)有关
前面提到可卡因可以减弱D2-MSNs对VP区的抑制作用,Kupchik教授指出同时用阿片受体(μ-opioid receptor)的阻断剂处理后,D2-MSNs对VP区的LTD效应又可以回复到正常水平。这暗示可卡因对D2-MSNs的作用可能由μ-opioid受体介导。
此外,Kupchik教授介绍有研究表明D1-MSNs除了分泌抑制型神经递质GABA外,还可以分泌激活型神经肽Dynorphin,这可能与D1-MSNs在可卡因成瘾过程中起促进作用有关,该项工作还在进行当中。
最后在提问环节,有老师问道D1-MSNs和D2-MSNs同属抑制型神经元,为什么在投射到VP区的D1-MSNs和D2-MSNs激活之后,对成瘾行为的作用相反。Kupchik教授表示这是一个非常好的问题,他们现在并不清楚其中的原因。他们也在关注这个问题。除此之外,还有许多精彩的提问,Kupchik教授都一一做出耐心的解答。本次学术报告在大家热烈的掌声中圆满结束。
参考文献:
1. Kupchik YM, et al. (2014) Cocaine dysregulates opioid gating of GABA neurotransmission in the ventral pallidum. The Journal of neuroscience : the official journal of the Society for Neuroscience 34(3):1057-1066.
2. Kupchik YM, et al. (2015) Coding the direct/indirect pathways by D1 and D2 receptors is not valid for accumbens projections. Nature neuroscience 18(9):1230-1232.
3. Heinsbroek JA, et al. (2017) Loss of Plasticity in the D2-Accumbens Pallidal Pathway Promotes Cocaine Seeking. The Journal of neuroscience : the official journal of the Society for Neuroscience 37(4):757-767.
4. Kupchik YM & Kalivas PW (2017) The Direct and Indirect Pathways of the Nucleus Accumbens are not What You Think. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology 42(1):369-370.