2017-08-25 | 单个突触小泡的内吞/Single Synaptic Vesicle Endocytosis
报告人:Ege Kavalali
整理人:武照伐
审核人:李毓龙
2017年8月25日上午,来自美国德克萨斯大学西南医学中心(UT Southwestern Medical Center)的Ege Kavalali教授应北京大学IDG/麦戈文脑科学研究所的邀请来到北京大学,在王克桢楼1113会议室为大家带来了一场题为“Single Synaptic Vesicle Endocytosis”的学术报告,本次报告会由周专教授主持。Ege Kavalali是Effie Marie Cain和Rosewood Corporation冠名教授,曾在斯坦福大学追随著名的华人神经生物学家钱永佑(Richard Tsien)从事博士后研究,他的实验室主要从事“通过电生理和光学手段研究突触小泡(Synaptic vesicle,SV)的循环机制”方面的研究。在本场讲座中,Kavalali教授“抽丝剥茧”般的讲述了他实验室在研究单个突触小泡循环机制方面的成果和进展。
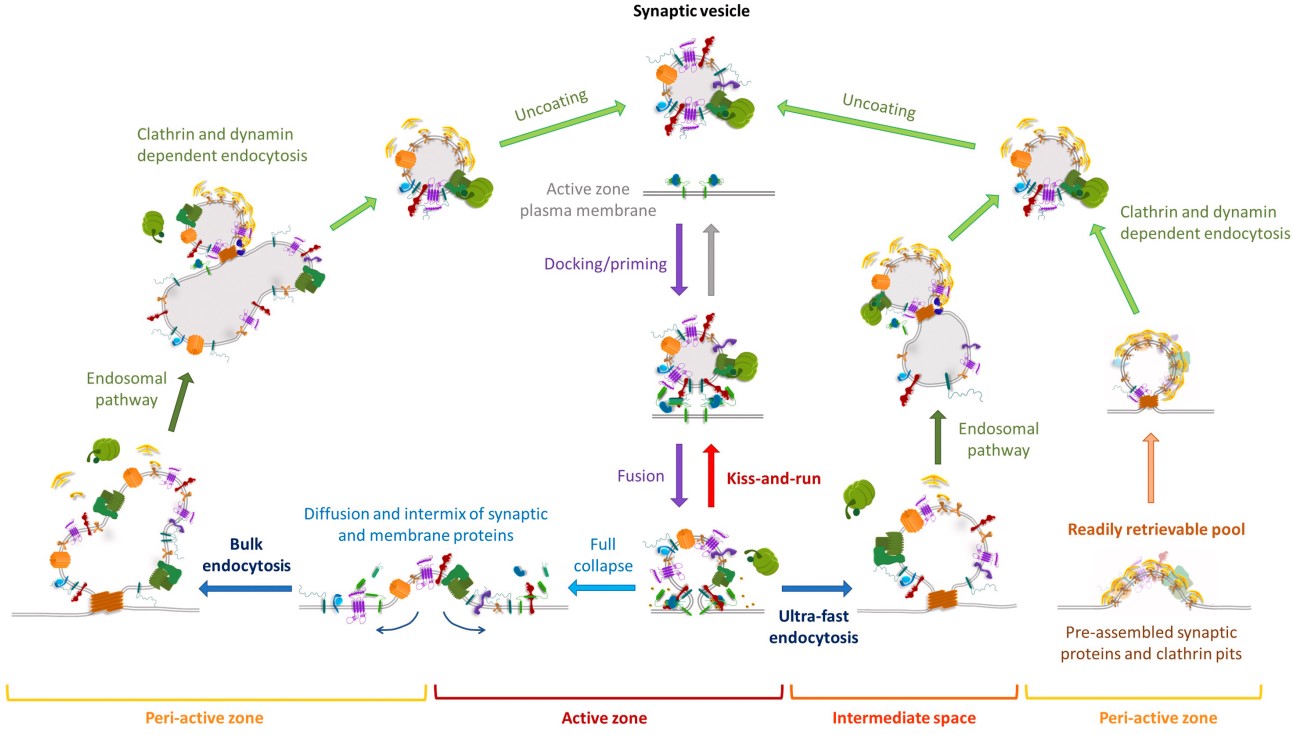
图1 突触小泡的循环(Chanaday and Kavalali, 2017)
一 研究SV循环的复杂性
神经元之间主要通过神经递质从而完成信息交流,突触前的动作电位会诱发Ca2+内流,促使突触小泡(SV)与突触前膜融合,从而释放储存在SV中的神经递质。那么SV是如何与突触前膜融合的?融合后又是怎么回收从而实现循环的?SV循环是一个非常复杂的过程(图1),主要表现在以下两个方面。
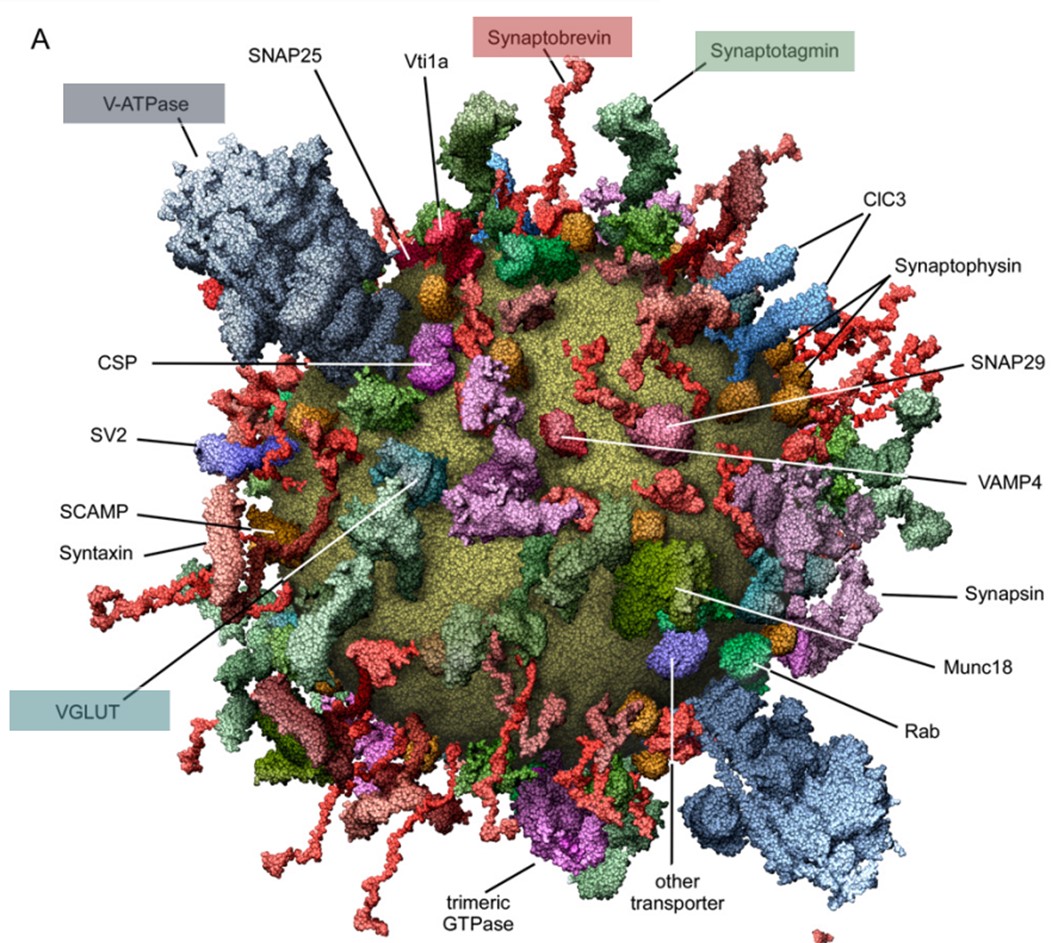
(1)作为细胞中最小的细胞器,SV有很多功能各不相同的蛋白(图2),比如:V-ATPase可以为神经递质在SV中的富集提供能量;转运蛋白(如VGLUT1)可以将神经递质转运到SV中;Synaptobrevin (V-SNARE)可以与t-SNAREs相互作用从而实现SV膜和突触前膜的融合;Ca2+感受器Synaptotagmin参与调节神经递质的释放。突触小泡如何运用这些蛋白实现快速的循环?
图2 突触小泡的分子模型(Takamori et al., 2006)
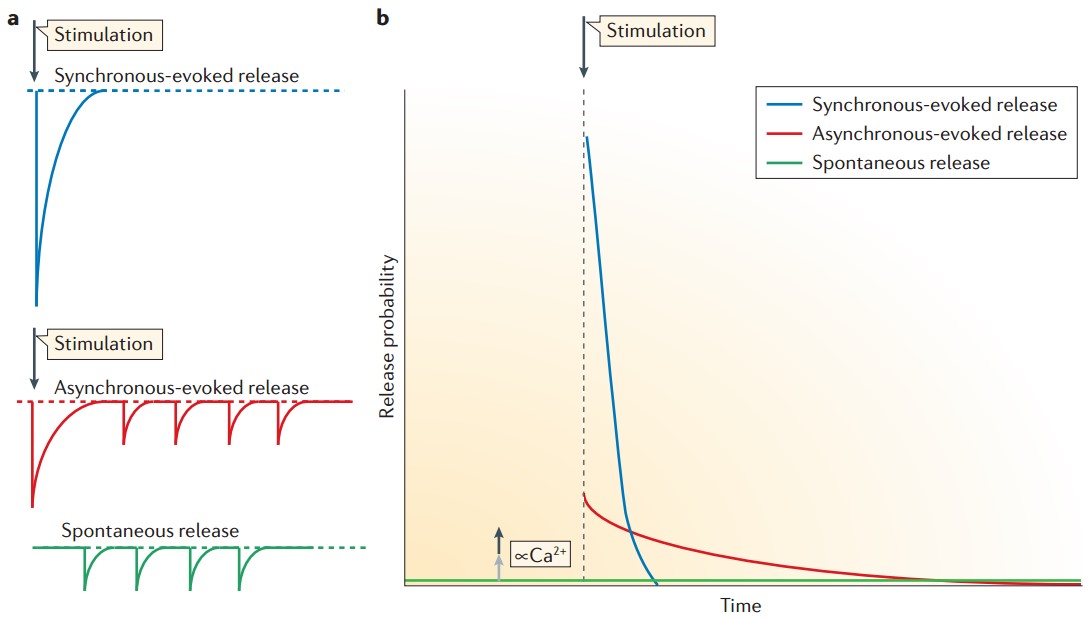
(2)突触传递的另一复杂之处在于有不同的神经递质释放的方式,根据Ca2+依赖性及时程的不同可以分为同步释放、同步释放及自发释放三种形式(图3)。这三种不同形式释放神经递质的关系?决定它们的分子机制是什么?
图3 神经递质释放的三种形式(Kavalali, 2015)
二 检测SV融合和内吞方法的建立
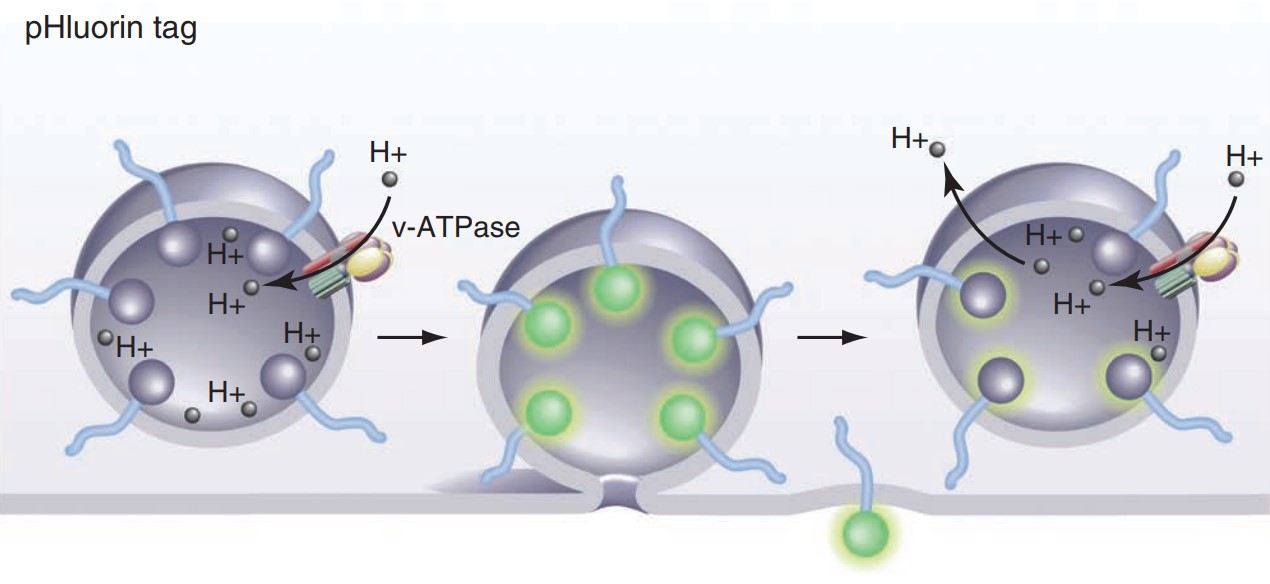
区分Ca2+在SV融合和内吞两个过程中的作用是非常困难的,因为大部分方法都依赖于检测多个SV内吞的叠加效果。为了解决这一技术难题,Kavalali教授实验室将连有pH敏感荧光蛋白(如pHluorin, pHTomato)的SV蛋白(如Synaptophysin, vGlut)作为探针(图4),通过低频率的刺激及高灵敏相机对信号的捕捉他们可以检测单个SV的内吞过程。实验结果表明,和预测的一样Ca2+可以增加SV融合的概率(probability),但是有趣的是Ca2+却会降低SV内吞的速率,并且这种负调节会被Ca2+螯合剂EGTA及钙调磷酸酶抑制剂FK506阻断。这也解释了重复刺激时突触前SV的聚集会减慢(Leitz and Kavalali, 2011)。
图4 pH敏感荧光蛋白用于检测突触小泡的释放和内吞(Kavalali and Jorgensen, 2014)
三 自发释放 vs 诱发释放
在突触前的末端除了动作电位触发的释放外,神经元有时还会自发的释放神经递质。然而这种自发性释放事件更加难以研究,因为它们发生的相对少见而且出现的也非常随机。同样的利用pH敏感荧光蛋白标记SV的方法,Kavalali教授实验室在突触前表达vGlut1-pHlourin探针,通过成像的方法检测单个自发释放事件,他们发现与触发释放相比,自发释放时SV内吞的速度非常快。通过突触前后的双色成像实验(突触前SypHTomato & 突触后PSD95_GCaMP5K),他们发现自发性融合事件与突触后NMDA受体引起的Ca2+信号相关联。虽然提高胞外Ca2+浓度并不会改变pHlourin荧光衰减的时间,表明胞外Ca2+不会改变单个自发性融合事件的动力学(kinetics);然而却会增加快速自发性SV融合及内吞事件发生的频率(rate)(Leitz and Kavalali, 2014)。既然自发释放和触发释放都与胞外的Ca2+相关,那么两者有什么关系呢?他们的实验发现虽然增加胞外Ca2+浓度时,整体的自发释放频率及触发释放概率都会增加,然而对于同一突触,自发释放频率(spontaneous response rate)却和触发释放(evoked response probability)发生的概率无关(Leitz and Kavalali, 2014; Reese and Kavalali, 2016)。
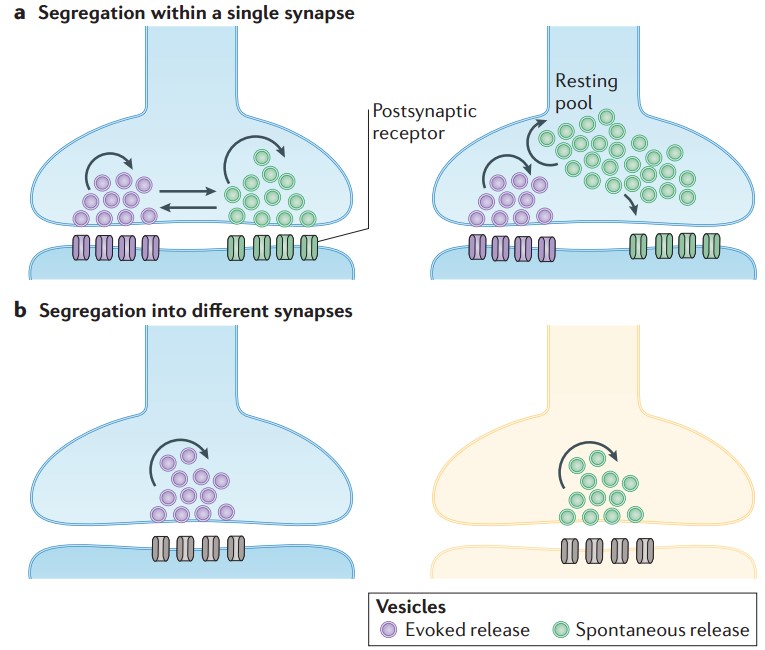
既然自发释放和触发释放都会引起神经递质的释放并触发突触后信号,那么它们在突触后是否有关系呢?Kavalali教授实验室使用非常灵敏的突触后定位的Ca2+探针GCaMP6s-PSD95,在体外培养的海马神经元中探究这一问题。结果发现在同一突触,使用功能依赖性的NMDA受体的抑制剂MK-801可以选择性的“沉默”自发释放引发的突触后信号,却不会影响触发释放引发的突触后信号;反之亦然。这表明在同一突触水平上,两种释放在诱发突触后功能上也是相互独立的(Reese and Kavalali, 2016)。这与其他实验室在果蝇上观察到的现象是一致的(Melom et al., 2013; Peled et al., 2014)。
图5 诱发释放和自发释放的相互隔离(Kavalali, 2015)
四 SV内吞的分子机制
SV的内吞过程是依赖于Ca2+的,那么分子水平上Ca2+是如何与其感受器如Syt1相互协调的?Kavalali教授实验室结合遗传学、药理学、电生理记录及荧光成像手段很好的回答了这个问题。在培养的海马神经元上,通过shRNA降低(KD)Syt1的表达后,vGlut1-pHlourin成像实验发现与WT相比,重复刺激虽然减慢了多个SV内吞,从而使神经递质释放的去同步;然而在单个SV水平,Syt1 KD却加快了融合事件引发的内吞,这表明Syt1在调节SV内吞过程中似乎有两种截然相反的功能。为了更好的解释Syt1的功能,他们使用Sr2+来代替Ca2+从而模拟Syt1 KD引起的“增强非同步释放”的表型。实验发现,Sr2+减慢了多个SV内吞,这与Syt1 KD的现象是一致的;在单个SV水平,Sr2+和Ca2+一样会减慢SV的内吞。由于在Syt1 KD时,Ca2+并不能减缓单个SV内吞,这说明Sr2+和Ca2+减缓单个SV的内吞是依赖于与Syt1的相互作用的。Syt1KD或是Sr2+替换都可以使神经递质释放变得非同步,这说明非同步释放时可能由一种更慢的内吞通路介导。为了进一步分析同步释放和非同步释放时SV的内吞之路,他们使用shRNA KD Complexin 1/2(会减少同步释放,增加非同步释放),实验发现Complexin 1/2 KD会减缓20Hz刺激条件下引发的多个SV内吞,然而对单个SV的内吞却几乎没有影响。随后的实验他们发现Syt1 KD后,另外一种Ca2+感受器Syt7可以支持非同步释放并可以减慢重复刺激下多个SV的回收,但是Syt7却不会影响单个SV内吞的动力学。那么两种Ca2+感受器是怎么相互协调以调节SV内吞的呢?随后的回补实验中他们发现,Syt1的Ca2+结合位点及膜结合能力会影响单个SV内吞动力学。而Syt7则更容易定位在细胞膜上,在强的刺激下可以发生内吞从而调节非同步释放过程中的SV内吞,基于实验结果他们提出了如图5的模型。
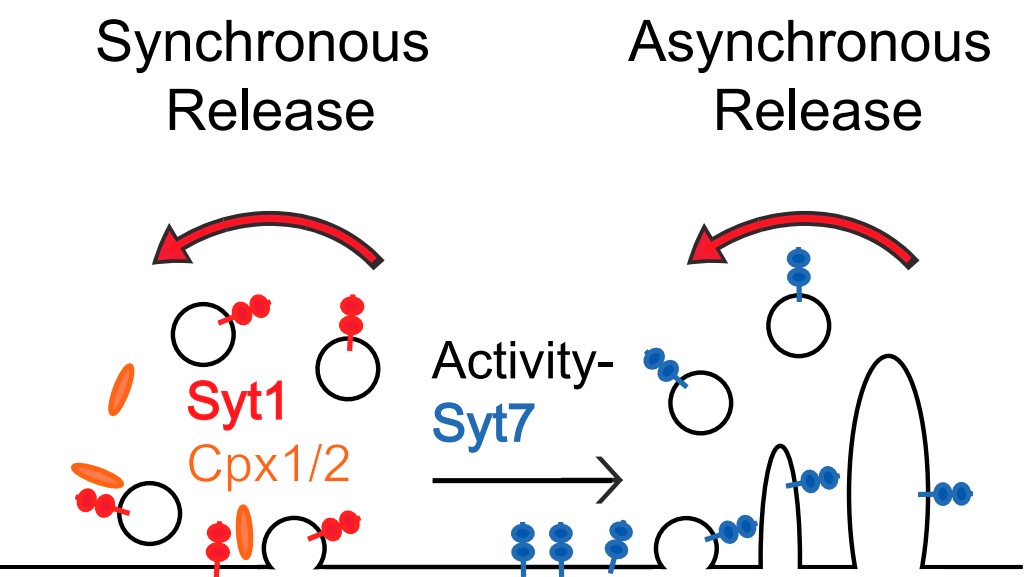
图6 Syt1和Syt7介导的SV内吞模型(Li et al., 2017)
除了以上发表的数据外,Kavalali教授还分享了一些未发表的数据。由于他们的实验大部分是在体外的室温操作的,那么生理条件下SV的内吞是什么样的呢?同样的检测方法下,他们发现与室温相比(25℃),生理温度(34℃)不会显著的改变单个SV内吞动力学。
随后Kavalali教授对本次报告做了总结,(1)自发性和诱发性神经传递过程在在突触前和突触后是分开的;(2)在特定突触上,自发融合是自主调节的,独立于诱发释放的概率;(3)Syt1和Syt7依赖性的融合机制引导SV走向不同的内吞通路;(4)生理温度下不会显著改变单个SV内吞的动力学特性。最后Kavalali教授与在场的老师和同学就相关问题进行了交流讨论,本场学术报告结束。
参考文献
Chanaday, N.L., and Kavalali, E.T. (2017). How do you recognize and reconstitute a synaptic vesicle after fusion? F1000Research 6.
Kavalali, E.T. (2015). The mechanisms and functions of spontaneous neurotransmitter release. Nature Reviews Neuroscience 16, 5.
Kavalali, E.T., and Jorgensen, E.M. (2014). Visualizing presynaptic function. Nature neuroscience 17, 10-16.
Leitz, J., and Kavalali, E.T. (2011). Ca2+ influx slows single synaptic vesicle endocytosis. Journal of Neuroscience 31, 16318-16326.
Leitz, J., and Kavalali, E.T. (2014). Fast retrieval and autonomous regulation of single spontaneously recycling synaptic vesicles. Elife 3, e03658.
Li, Y.C., Chanaday, N.L., Xu, W., and Kavalali, E.T. (2017). Synaptotagmin-1-and Synaptotagmin-7-Dependent Fusion Mechanisms Target Synaptic Vesicles to Kinetically Distinct Endocytic Pathways. Neuron 93, 616-631. e613.