Eunjoon Kim:Early and late corrections in mouse models of ASD
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据韩国基础科学研究所脑突触异常研究中心主任、韩国先进科学技术研究所生物科学系教授Eunjoon Kim所作题为“Early and late corrections in mouse models of ASD”的报告整理而成。

Eunjoon Kim教授在线作学术报告
整理:陈 聪
审核:苗成林
Eunjoon Kim教授主要从事于兴奋性突触发育和可塑性分子机制的相关研究,并试图揭示不同突触蛋白所介导的自闭症的发病机制。自闭症是一种神经发育障碍性疾病,最主要的两个症状为社交障碍和刻板行为,并常常伴有极度活跃、焦虑、癫痫等并发症状。该病在人群中的流行率为~1.5%,在男性中的患病率会比女性高出4-5倍,并具有高度的遗传性。目前尚没有FDA通过的能够有效治疗自闭症的药物。关于自病症的发病机制目前尚不明确,突触和神经环路中兴奋性和抑制性的失调以及NMDA受体的功能异常是两种可能的神经机制。在早期的研究中,人们发现突触后表面蛋白Neuroligin-1的缺失会导致空间记忆受损,并会增加动物的刻板行为。在突触层面,NMDA受体所介导的突触传递发生明显的下降,当给予NMDA受体的兴奋剂D-环丝氨酸(DCS,D-cycloserine)来激活其功能时,缺失小鼠的刻板行为可以得到很大的缓解。因此人们将NMDA受体的功能异常和动物的刻板行为相偶联,在NMDA受体正常功能的范围内,动物表现正常;当其功能下降时,动物会表现出自闭症样的重复刻板行为。Eunjoon Kim实验组主要在各种突变小鼠中研究NMDA受体的功能异常与自闭症样症状的关联。例如在Shank基因突变的小鼠中人们发现了相似的现象,Shank2是一种兴奋性突触后铰链蛋白,Shank2-/-小鼠主要表现为社交功能障碍,相较于野生型小鼠,Shank2-/-小鼠在社交偏好实验中更少和陌生小鼠发生互动,而更多探索摆放的物体。同时Shank2-/-小鼠也伴随着NMDA受体的功能下调,其社交障碍可以通过NMDA受体的兴奋剂D-环丝氨酸得到缓解。
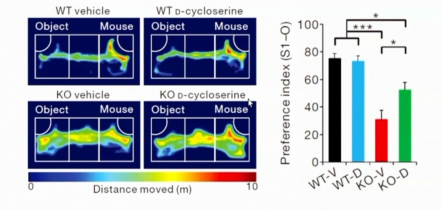
图1. Shank2-/-小鼠社交障碍可以通过NMDA受体的激活(D-环丝氨酸)得到缓解(Won et al., 2012)
Eunjoon Kim教授在论坛报告中阐述的工作主要针对NMDA受体的功能异常在自闭症中发挥的作用,其中有几个关键的问题:早期和晚期矫正中NMDA受体发挥怎样不同的作用;不同类型的细胞(谷氨酸能神经元和γ-氨基丁酸能神经元)以及各种细胞亚型如何参与自闭症的发病过程;如果NMDA受体对于自病症的发生十分关键,能否找到NMDA受体突变的病人;使用NMDA受体的激动剂治疗自闭症会产生很多副作用,能否找到更加高效的新型分子来调节NMDA受体的功能。
自闭症发病相关的基因可能在胚胎期、出生后、青年期和成年表达,在不同时期的干预可能会产生不同的影响,因此对于自闭症的干预时期非常重要。干预时期通常可分为早期干预和晚期干预,但无论是早期干预还是晚期干预,都存在干预的关键时期,在此时期神经元对外界干预敏感,并且此时期的干预会产生持久的影响。在第一部分的工作中,研究人员试图在Shank2-/-小鼠中进行自闭症行为的早期干预。他们发现在二周龄Shank2-/-小鼠的海马中NMDA受体功能上调,而在三周龄Shank2-/-小鼠中NMDA受体功能明显下调,在内侧前额叶皮层(mPFC,medial prefrontal cortex)中也有相似的现象。因此二周至三周为Shank2-/-自闭症小鼠的关键矫正时期。在2-3周野生型小鼠中也存在着NMDA受体的功能下调,但是在二周龄Shank2-/-小鼠中NMDA受体的激活高于野生型,这可能代偿性地介导了NMDA受体后期的过度失活,这种变化会在之后稳定的保存下来。实验通过NMDA受体的拮抗剂Memantine在早期抑制NMDA受体的活性,发现早期抑制能够在后期增强NMDA受体的活性,减少小鼠的自闭症样行为,并且这种变化是持久而稳定的。
在近些年的研究中,研究人员试图在Shank2-/-小鼠中条件敲除某些特定类型的神经元,发现谷氨酸能神经元和γ-氨基丁酸能神经元在Shank2-/-小鼠中都发挥了重要的作用。为了探究自闭症相关的皮层机制,Eunjoon Kim研究组在之后的研究中比较了野生型小鼠和Shank2-/-小鼠在社交偏好实验中的神经元活动。当野生型小鼠接近陌生小鼠时,mPFC神经元活动增强,而探索物体时 mPFC神经元基本没有响应;在Shank2-/-小鼠与陌生小鼠的互动中同样伴随着mPFC神经元活动的增强,但是当Shank2-/-小鼠探索放置的物体时,mPFC神经元会发生更强烈的响应。为了进一步比较野生型小鼠和Shank2-/-小鼠mPFC神经元放电特征的差异,研究人员根据动作电位的形状将记录到的神经元分为假定兴奋性(pExc,putative excitatory)神经元和假定抑制性(pInh,putative inhibitory)神经元。他们发现无论在野生型小鼠还是Shank2-/-小鼠中,pExc神经元在面对社交小鼠、物体等对象时都会提高放电频率,而pInh神经元不具有这种特征。但是两种小鼠的高频脉冲式放电(high-frequency burst firing)在pInh神经元中存在明显差异,在Shank2-/-小鼠中pInh神经元在发放一次动作动作电位后再次发放动作电位的频率明显降低。为了进一步揭示其中的突触机制,研究人员分别记录了野生型小鼠和Shank2-/-小鼠前边缘皮层(prelimbic cortex)2/3层Pv神经元和PN神经元自发兴奋性突触后电位和抑制性突触后电位,发现在两种小鼠中的基线突触传递和神经元兴奋性并不存在差异。之后研究人员利用光遗传学方法研究Pv神经元到PN神经元诱发性的抑制性突触传递,在野生型小鼠中,当Pv神经元被光激活时,PN神经元的放电频率下降,而在Shank2-/-小鼠中并没有表现出Pv神经元激活相关的放电频率下降。在Shank2-/-小鼠中Pv神经元对PN神经元的抑制受损可能与Pv神经元放电特性的变化有关。因此在之后的实验中研究人员在脑片上激活单一的Pv神经元,他们发现在被激活的同一个神经元和邻近的神经元中,其大于80Hz的簇状放电相较野生型小鼠明显增加,在邻近的神经元中还可引起神经元放电频率的增高。Pv神经元之间主要通过间隙连接(gap junction)相联系,这种间隙连接被认为可以调节Pv神经元之间的放电和群体网络活动。为了直接验证在Shank2-/-小鼠中间隙连接是否参与了Pv神经元增强的簇状放电,研究人员利用mefloquine抑制间隙连接蛋白connexin-36,抑制后Shank2-/-小鼠邻近神经元的簇状放电明显减少。因此间隙连接的过度活跃会促进Pv神经元的簇状放电。
Shank2-/-小鼠的社交功能障碍与海马和皮层兴奋性神经元NMDA受体的活性下降有关,那么在Shank2-/-小鼠中NMDA受体的功能异常是否与Pv神经元簇状放电特性改变相关联。为了解决这个问题,研究人员在脑片上施加NMDA受体的兴奋剂DCS,发现无论在野生型小鼠还是在Shank2-/-小鼠中,DCS都可以显著增加邻近神经元的簇状放电。同时如果用mefloquine阻断间隙连接的功能,邻近Pv神经元的簇状放电会发生明显的下降。这些结果表明NMDA受体可能会与间隙连接相互协同共同促进Pv神经元的簇状放电。
在之后的实验中,研究人员利用不同频率的脉冲模拟间隙连接对Pv神经元的激活,来观察这是否会对动物的社交行为产生影响。研究发现无论是40Hz的脉冲或者是持续激活神经元,都没有办法增加实验小鼠对社交小鼠的探索。而能够引起邻近神经元簇状放电的10Hz的激活脉冲,可以增加实验小鼠对社交小鼠的偏好,并且可以减少Shank2-/-小鼠mPFC中对物体响应的神经元。因此利用10Hz的脉冲不仅可以激活Pv神经元的簇状放电,并且可以提高动物的社交表现和皮层的社交表征。
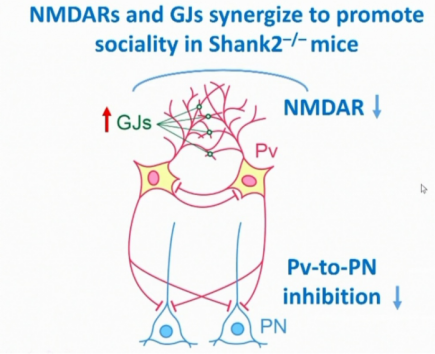
图2. NMDA受体和间隙连接共同促进Pv神经元簇状放电并改善Shank2-/-小鼠社交表现总结图
在最后的部分,Eunjoon Kim教授分享了他们在影响NMDA受体功能的小分子和受体方面的工作。甘氨酸是NMDA受体的协同激活剂,胞外甘氨酸的浓度主要通过甘氨酸转运蛋白GlyT1和GlyT2来维持。在之前的研究中有许多实验试图通过阻断GlyT1和GlyT2来增加胞外甘氨酸的浓度,从而治疗一些与NMDA受体功能下调有关的疾病,例如精神分裂症。尽管甘氨酸在全脑都有分布,但是甘氨酸转运蛋白GlyT1和GlyT2大多分布在脑干和小脑,而在皮层和海马分布较少,因此通过GlyT1和GlyT2的阻断剂很难在这些脑区阻断甘氨酸的转运。甘氨酸在大脑中发挥着重要的作用,那么在GlyT1和GlyT2分布较少的脑区,一定存在另外的转运蛋白调控胞外甘氨酸的浓度,基于这样的策略,Eunjoon Kim实验室试图找到新的转运蛋白,从而能够在皮层和海马来调控甘氨酸的转运。突变小鼠PTEN△C会表现出过度攀爬的刻板行为,在这种小鼠中可以检测到CA1和mPFC中NMDA受体的功能下调。通过RNA-Seq分析,他们发现在PTEN△C小鼠中Slc6a20a基因表达上调。SLC6A20A是一种脯氨酸转运蛋白,但是在PTEN△C小鼠中研究人员不仅发现了胞外脯氨酸浓度的下降,同时胞外甘氨酸浓度相较野生型也明显降低。为了直接验证SLC6A20A蛋白可以转运脯氨酸和甘氨酸,研究人员在HEK293T细胞中表达SLC6A20A蛋白,并记录脯氨酸和甘氨酸浓度依赖的转运电流,他们发现在这些细胞中甘氨酸和脯氨酸的转运水平基本相似。通过FISH和之前原位杂交的结果,SLC6A20A在包括脑膜、皮层、海马、脉络丛和丘脑的各个大脑区域表达;在细胞层面上,SLC6A20A主要在星形胶质细胞和小胶质细胞中表达。在后续的实验中,研究人员在小鼠中敲除Slc6a20a基因成功增加了甘氨酸的浓度并提高了NMDA受体的功能。因此Slc6a20a基因可以作为治疗与NMDA受体功能下调相关的精神分裂症和自闭症的下一个靶标。
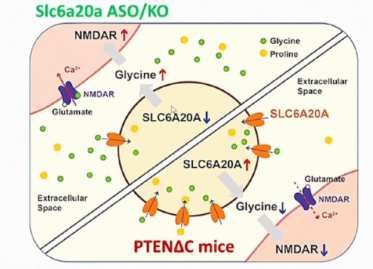
图3. SLC6A20A蛋白对胞外甘氨酸浓度和NMDA受体功能影响总结图
报告中,Eunjoon Kim教授分享了实验室关于NMDA受体在自闭症中发病机制的最新进展。在Shank2-/-小鼠中早期抑制NMDA受体的功能可以在后期提高NMDA受体的活性,并可稳定而持续地改善小鼠的自闭症样行为。Shank2-/-小鼠中Pv神经元对于锥体细胞的抑制作用减弱,而Pv神经元之间的间隙连接加强,这种加强可能是为了代偿性的弥补NMDA受体的功能下调。在PTEN△C小鼠中,他们发现了SLC6A20A蛋白可以调控胞外甘氨酸浓度,从而影响NMDA受体的功能,因此Slc6a20a基因可以作为治疗自闭症的新靶标。
参考文献
1. Bae M, Roh JD, Kim Y, et al. SLC6A20 transporter: a novel regulator of brain glycine homeostasis and NMDAR function. EMBO Mol Med. 2021;13(2):e12632.
2. Lee E, Lee S, Shin JJ, et al. Excitatory synapses and gap junctions cooperate to improve Pv neuronal burst firing and cortical social cognition in Shank2-mutant mice. Nat Commun. 2021;12(1):5116.
3. Won H, Lee HR, Gee HY, et al. Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function. Nature. 2012;486(7402):261-265.