Winfried Denk: Signals and wires, how do they compute?
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据德国马普所神经生物学研究所(Max Planck Institute of Neurobiology)的Winfried Denk教授,所作的题为“Signals and wires, how do they compute?”的学术报告整理而成。
Winfried Denk教授作学术报告并与嘉宾观众交流
撰稿:周昱乾
审核:苗成林
Winfried Denk教授提到,经过20多年在双光子显微镜方面的研究,自己逐渐对双光子显微技术感到厌倦。诚然双光子技术依然是非常好用的技术,但是Denk教授希望带来一些新的东西。
首先,Denk教授展示了团队最后一项双光子显微成像方面的研究。Thomas Euler等人用双光子显微镜从体外分离的兔子光敏视网膜中,观察星爆无长突细胞(starburst amacrine cells)的树突对光刺激的反应,发现这种细胞对光刺激具有方向选择性(图1)。在此之前,一般认为光信号的方向从神经节细胞开始处理。Denk团队的这一发现说明,在神经节细胞之前的星爆无长突细胞已经开始进行处理。这种功能上的特性令人不禁好奇,星爆无长突细胞到神经节细胞之间,是以何种方式进行突触连接,从而实现信息传输整合?

图1:利用双光子成像技术探究星爆无长突细胞
以此研究为引,Denk教授展示了他发明的另一项技术--串行块面扫描电子显微镜(SBEM)。这项技术通过对组织块边切片边扫描的方式获取组织块3D高分辨率的图像信息,在分辨率足够高的情况下可以用于神经连接的研究。
Kevin Briggman继续开展了前文的方向选择性研究。他将SBEM与双光子技术结合,将双光子技术成像的组织块用于SBEM拍摄,即可获得同一组织块的功能信息和组织学信息。将两部分数据结合分析,可以重构出视网膜方向选择性细胞在解剖学上的突触分布与连接(图2)。这种分析可以很好地结合功能性与解剖学方面的特性,让细胞的功能与突触连接互相印证,有利于理解结构与功能的关系,也能使数据更加可靠。

图2:将视网膜细胞的解剖学连接信息与功能学信息一一对应
Denk团队将Harald F. Hess团队的气体团簇离子束运用到块面扫描电镜中,显著提高了成像速度、成像分辨率,同时成像的同步性更好,有利于后续的数据处理。这项改进将分辨率提高到约10 nm,一次激光阵列扫描可获得约10 G像素的图像,对大、小组织块均有较好的成像效果。
Denk团队与其他团队合作,利用改进后的技术开展了神经连接组学方面的研究。Fee和Goldberg提出过鸟鸣的神经环路模型,此环路中,RA脑区主要接收HVC和LMAN的投射。这个模型预测,大多数HVC投射神经元的末端终止于树突棘,他们利用改进过的块面扫描电镜技术验证了这一观点(图3)。
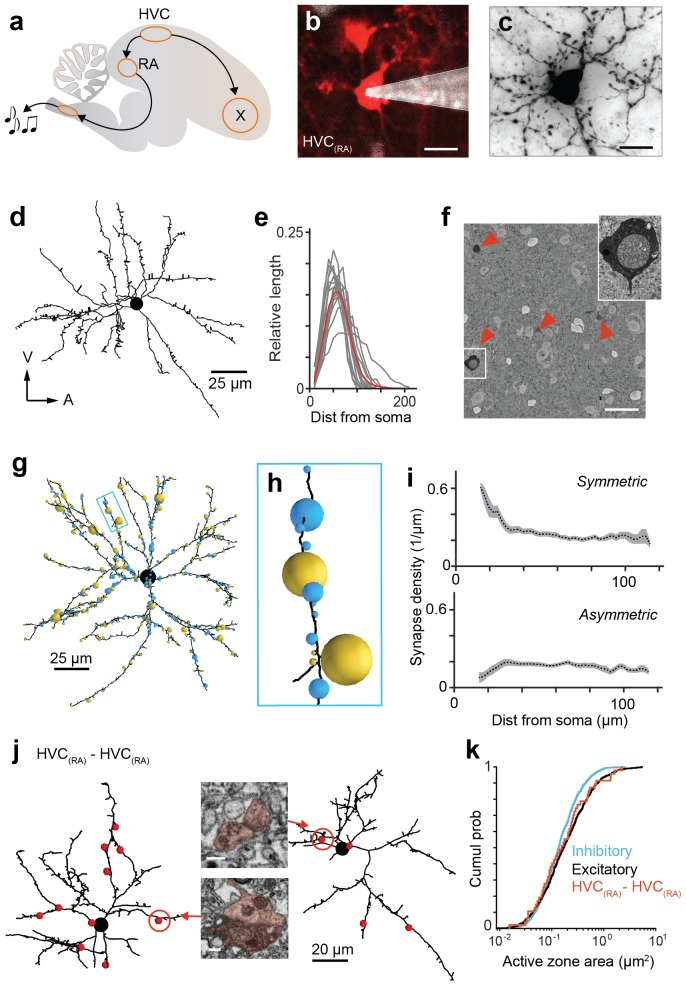
图3:HVC向RA投射的突触连接特性
在介绍完前面的成果之后,Denk教授将大家的目光从微观的突触连接转移到宏观的概念来:研究神经环路到底是想研究什么?整体来说,外界给神经环路输入刺激,复杂的神经环路最终对刺激产生应答,体现在输出的行为上。而神经环路在处理刺激的过程中在不断发展,发展则主要通过基因表达蛋白来调控。而基因在演化的过程中不断修饰变化。
由此引出了Denk团队用冷冻电镜对生物大分子的研究。他们开发了一种计算方法,可以从冷冻电镜拍摄的簇集大分子照片中探测到单个的蛋白质分子。Denk举了核糖体成像的例子,可以从照片中看到核糖体在mRNA进出时的形态变化,生动地展示了该技术对成像的帮助。
在提问环节,北京大学陈良怡教授提问:这种冷冻电镜技术在对具有多种构象和旋转状态的蛋白质成像方面的极限在哪?
Denk指出,他展示的成像例子中,检测到了同一种蛋白分子的6万多次成像数据,这些数据理应足够重构具有多种旋转状态的蛋白质分子。
陈良怡教授继续问了一个相关的问题:在细胞内进行生物大分子成像时,信噪比相比于纯化过的蛋白要低很多。在这种前提下,冷冻电镜重构出的高分辨率结构能否作为模型应用于细胞内高分辨成像?
Denk回答,细胞内成像选取的结构模型并不一定需要高分辨率。很多人选择较低分辨率的模型,就是为了可以分析蛋白在不同构象的性质。如果用高分辨模型,反而有可能偏好于识别蛋白的一些构象而忽略其他构象。相关问题如果想进一步讨论可以与Peter联系。
最后,主持人吴思教授提问:Denk教授预期5-10年后可以实现对小鼠全脑的连接组学重构,请问Denk是如何做出这一预期的?
Denk回答说,他只是对此非常乐观。如果要解释的话,主要是目前我们已经有了连接组学重构的技术,已经在理论上可以实现全脑重构。但是依然存在阻碍,全脑连接组学重构需要极大的资金投入,我们难以证明全脑重构的可行性,也就难以获得足够的资金来开展这项大工程。因此,我们需要时间来建立起一个完善的全脑重构流程,以此展示全脑重构的可行性。
参考文献
[1] Euler, Thomas et al. “Directionally selective calcium signals in dendrites of starburst amacrine cells.” Nature vol. 418,6900 (2002): 845-52. doi:10.1038/nature00931
[2] Briggman, Kevin L et al. “Wiring specificity in the direction-selectivity circuit of the retina.” Nature vol. 471,7337 (2011): 183-8. doi:10.1038/nature09818
[3] Kornfeld, Jörgen et al. “EM connectomics reveals axonal target variation in a sequence-generating network.” eLife vol. 6 e24364. 27 Mar. 2017, doi:10.7554/eLife.24364
[4] Rickgauer, J Peter et al. “Single-protein detection in crowded molecular environments in cryo-EM images.” eLife vol. 6 e25648. 3 May. 2017, doi:10.7554/eLife.25648