徐祥敏:加州大学尔湾分校神经环路研究平台为神经疾病解析及治疗辟新径
撰稿:杨珮琳 审核:冯杰思

2024年4月3日,加州大学尔湾分校(University of California, Irvine)徐祥敏教授应北京大学IDG麦戈文脑科学研究所、生命科学学院李毓龙教授邀请,在金光生命科学楼邓祐才报告厅带来了一场题为"UC Irvine center of neural circuit mapping, viral genetic tools and single-cell and spatial transcriptomics"的精彩学术报告。李毓龙教授主持报告会。本期学术笔记根据徐祥敏教授的报告整理而成。
徐祥敏教授首先介绍了他作为主要创立人之一在UCI建立的Center for Neural Circuit Mapping (CNCM)。他通过联合多个领域的研究者,开展了多项拥有雄厚资金支持的脑科学研究项目。此外,CNCM还拥有非常丰富的病毒工具资源(包括腺病毒、慢病毒、狂犬病毒和疱疹病毒等)和单细胞及空间多组学资源。
徐祥敏教授本次介绍的研究工作包括用于神经环路研究的病毒工具的开发、利用这些病毒工具对于健康和疾病情况下神经环路的解析,以及利用单细胞空间转录组学方法研究模式动物阿尔茨海默病(Alzheimer’s disease,AD)的发生过程。
一、 开发病毒工具用于神经环路研究
在过去20年中,神经病毒已被用于绘制神经环路图,以及递送用于生理分析的分子标记物和效应物。病毒工具对于完整大脑中细胞类型特异性和环路特异性神经网络的解析和功能研究至关重要。其中,跨突触示踪病毒可以穿过突触并扩散到神经环路中的其他神经元,根据其扩散方向,分为顺行(从突触前神经元扩散到突触后神经元)和逆行(从突触后神经元扩散到突触前神经元)病毒。
狂犬病病毒(rabies virus, RV)经过改造后可以作为逆突触示踪病毒。野生型RV在感染大脑时会进行逆行的多突触扩散。为了防止其多突触扩散,可以删除编码病毒糖蛋白(G)的基因,得到RVΔG。结合RVΔG与反式互补的辅助病毒(表达RVG蛋白)可以实现逆行的单突触扩散。这一套系统可以在许多脊椎动物中介导逆突触的标记,包括啮齿类和非人灵长类。
当前面临的挑战是如何提高现有成像手段的分辨率至电镜(electromicroscope, EM)尺度,以及允许在成像尺度之间进行比较的标记,以帮助推动下一代连接组学研究。为了实现这些目标,徐祥敏教授研究组新开发了20种新的重组狂犬病病毒载体,可以用于解析多尺度和多模态神经环路(表1)。通过设计重组RV,使其表达具有不同波长和不同亚细胞定位的荧光报告基因、铁蛋白(ferritin)和荧光素酶(luciferase),可以实现从微尺度(EM)到中尺度(FM)水平的环路解析(Bouin, A. et al. Mol Psychiatry, 2024)。

表1 20种重组狂犬病毒变异株的总结(Bouin, A. et al. Mol Psychiatry, 2024)
举例来说,利用SAD-B19-RVΔG PSD95-mNeonGree,将绿色荧光蛋白mNeonGreen与突触后致密区的一种脚手架蛋白PSD95融合表达在皮层锥体细胞中,可以清楚地看到树突棘(图1A)。进一步在C57野生型和5xFAD小鼠(阿尔茨海默病小鼠模型)的海马CA1分别注射上述病毒,与9月龄野生型小鼠相比,9月龄5xFAD小鼠的CA1脑区可以看到明显降低的树突棘密度,如图1B箭头所示。
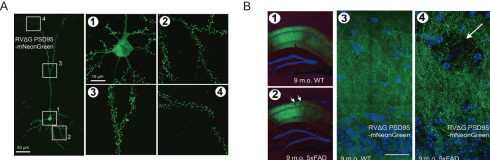
图1 使用病毒工具对树突棘进行标记,其在小鼠阿尔茨海默病病程中逐渐变少(Bouin, A. et al. Mol Psychiatry, 2024)
二、健康和疾病状态下的海马神经环路
经典的海马投射路径是单向的,即从内嗅皮层(entorhinal cortex, DC)-齿状回(dentate gyrus, DG)-CA3-CA1-海马下托(subiculum,SUB)。利用上述一系列顺突触和逆突触示踪的病毒工具和光激活手段,徐祥敏教授研究组在小鼠中鉴定了一条从SUB-CA1的反向投射通路(图2)。进一步,通过化学遗传学和光遗传学方法分别抑制和激活SUB-CA1通路,可以分别损害和改善小鼠对于物体-位置关系的记忆编码(图3),而物体-位置记忆作为一种关键的空间认知形式,与人类和动物导航相关(Sun, Y. et al. Nat Neurosci, 2019)。
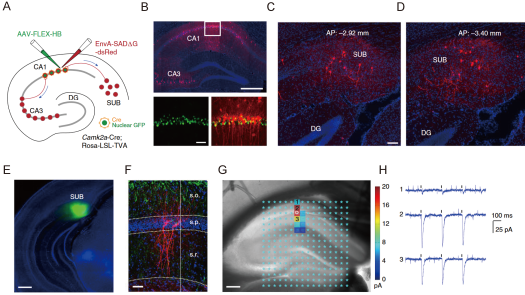
图2 在CA1注射逆突触病毒表达荧光蛋白可以在SUB观察到信号。光激活刺激SUB也可引起CA1神经元的兴奋(Sun, Y. et al. Nat Neurosci, 2019)
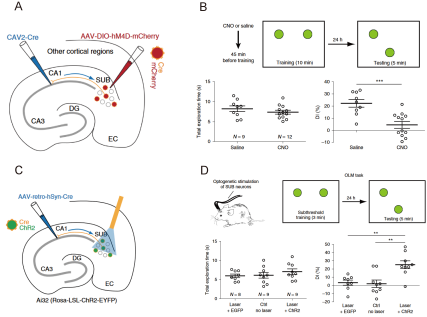
图3 抑制或激活SUB-CA1通路分别损害或改善小鼠的物体-位置记忆(Sun, Y. et al. Nat Neurosci, 2019)
除了鉴定新的非经典的神经环路,上述病毒工具同样也可以用来监测在疾病发生过程中神经环路的变化。痴呆以及年龄相关的认知能力衰退在全球都是备受瞩目的健康问题,阿尔茨海默病(AD)是最常见的成人痴呆症形式。最近AD研究出现了一个新方向,即神经环路机制紊乱导致认知功能逐步丧失。来自人类和动物模型的证据表明,神经环路失调会引发一系列病理事件,最终导致学习、记忆和其他认知功能的丧失。最近的证据表明,AD的特点是长程和局部神经环路连接的破坏。而海马CA1是一个与空间学习和记忆有关的脑区,也是阿尔茨海默病患者最易受伤害的脑区之一。因此他们开创性地将单突触RV示踪法应用于AD小鼠模型的海马神经环路研究中(Ye, Q. et al. Neurobiol Dis, 2022)。以过度表达淀粉样前体蛋白(APP)的转基因小鼠(APP-KI)作为AD小鼠模型,测量其在疾病发生过程中的神经连接强度的变化。结果显示无论年轻还是年老,AD小鼠模型的海马神经环路连接都有所下降(图4)。
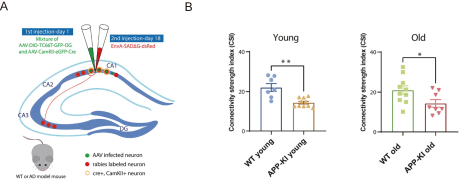
图4 单突触RV示踪技术显示APP-KI小鼠的海马神经环路连接总体上有所降低(Ye, Q. et al. Neurobiol Dis, 2022)
三、利用单细胞空间多组学方法研究模式动物阿兹海默症的发生过程
除上述精彩的工作以外,徐祥敏教授还介绍了一项未发表的工作。依托CNCM丰富的单细胞及单细胞空间转录组学资源,徐祥敏教授课题组联合其他课题组使用MERFISH技术测量了野生型和AD小鼠模型的单细胞空间转录组,生成了大尺度的空间分辨单细胞基因表达图谱。通过对这些表达谱的分析发现了许多有趣的现象。
此外,AD研究领域目前正在寻找比转基因小鼠模型更具转化潜力的非传统模型,这些动物模型包括八齿鼠(Octodon degu)、狗(Canis familiaris)和某些非人灵长类动物,它们可以更好地再现人类阿兹海默症的神经病理学和认知障碍。八齿鼠是智利的一种长寿的啮齿动物,会出现自发的年龄依赖的神经病理学和认知障碍,类似于人类的AD。但少数已发表的使用不同遗传背景八尺鼠的研究中,关于散发性类AD病理特征的研究结果并不一致。因此,徐祥敏教授研究组对八齿鼠自发发生的类似AD的病理和行为进行了更充分的研究(Tan, Z. et al. Acta Neuropathol Commun, 2022)。他们在认知功能受损的年老的远交系八齿鼠亚群中发现了类似AD的神经病理学标志物:淀粉样蛋白沉积和tau异常形式。他们还发现行为缺陷型老年八齿鼠具有显著的神经退行性特征,包括海马神经元缺失、皮层中c-Fos神经元激活增加等,这与已报道的人类AD患者的特征一致。上述结果证明年老的八齿鼠可以作为自然散发性AD的模型。
综上,随着神经环路研究在大脑失调相关疾病研究中越来越重要,徐祥敏教授研究组通过开发用于神经环路研究的病毒工具,并将这些病毒工具与单细胞空间转录组学方法、新的非传统动物模型相结合,聚焦于阿尔兹海默病中神经环路的解析,为理解和最终治疗阿尔兹海默病指明了新的方向。
参考文献
1. Bouin, A. et al. New rabies viral resources for multi-scale neural circuit mapping. Mol Psychiatry (2024).
2. Sun, Y. et al. CA1-projecting subiculum neurons facilitate object–place learning. Nat Neurosci 22, 1857–1870 (2019).
3. Ye, Q. et al. Hippocampal neural circuit connectivity alterations in an Alzheimer’s disease mouse model revealed by monosynaptic rabies virus tracing. Neurobiol Dis 172, 105820 (2022).
4. Tan, Z. et al. Cognitively impaired aged Octodon degus recapitulate major neuropathological features of sporadic Alzheimer’s disease. Acta Neuropathol Commun 10, 182 (2022).