北京大学神经科学研究所王韵课题组在《Journal of Neuroscience》杂志发表文章,发现神经系统发育晚期调控海马神经元突触功能和可塑性的关键信号通路,为最终揭示突触发育和神经环路形成过程中多样、精确的分子调控机制提供了新思路。
2017年11月13日,北京大学神经科学研究所王韵研究组在《Journal of Neuroscience》杂志发表题为" PKD1 promotes functional synapse formation coordinated with N-cadherin in hippocampus "的研究论文。文章使用了分子生物学、生物化学、形态学和电生理学等多种实验方法,揭示了蛋白激酶D1(Protein kinase D1,PKD1)通过增加神经型钙粘素(N-cadherin)的膜定位并促进突触发育和突触功能的潜在机制。
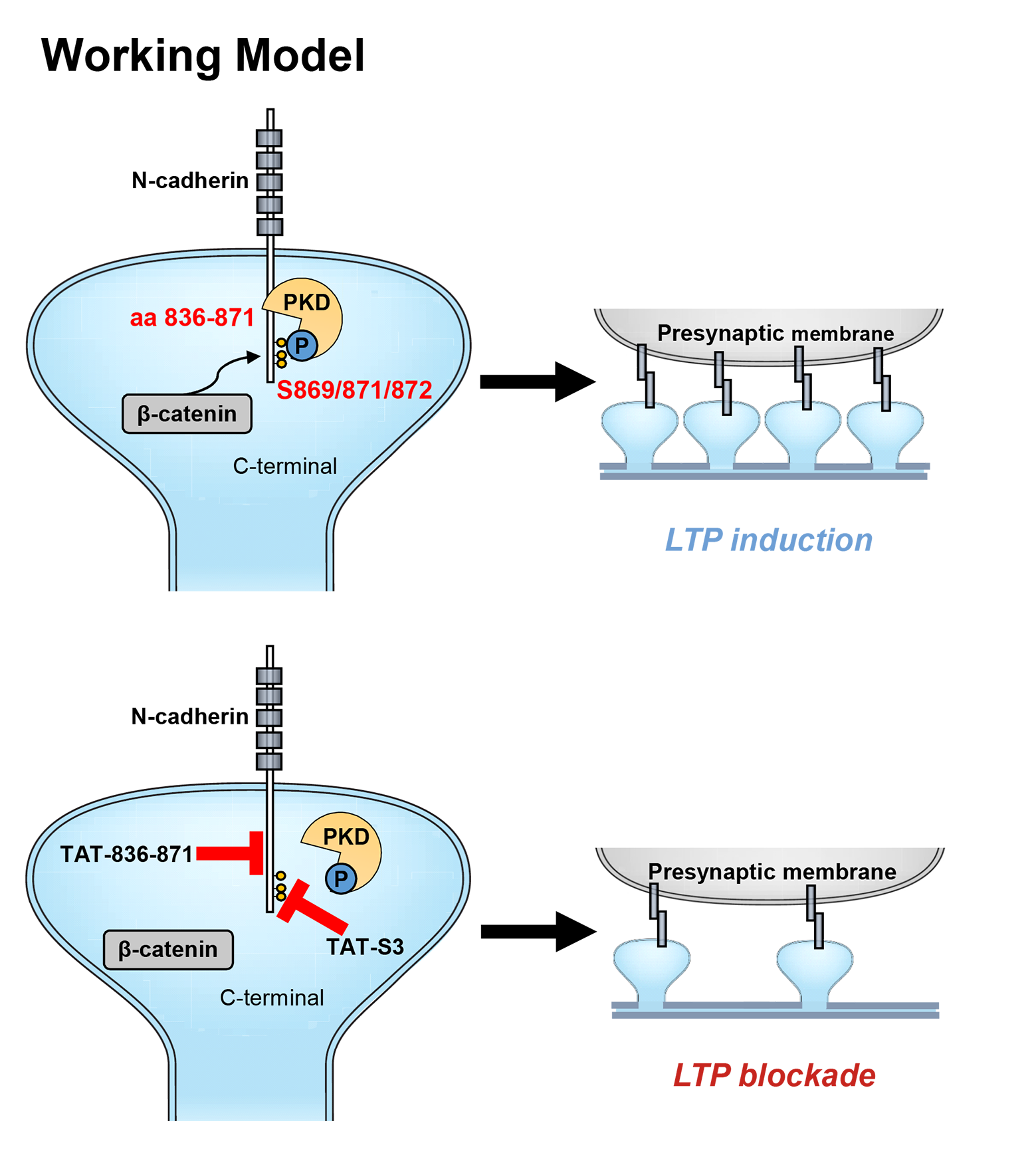
PKD1通过与N-cadherin 836-871位的氨基酸结合并磷酸化N-cadherin 869, 871, 872位的丝氨酸增加N-cadherin的膜定位,促进突触发育和突触功能。阻断PKD1与N-cadherin的相互作用导致N-cadherin的膜定位减少,其与b-catenin的结合能力降低,进而阻断突触发育和LTP的形成。
神经系统中,突触是两个神经元相连并传递信息的部位,其结构基础是突触前的轴突末梢和突触后的树突棘。神经元之间通过突触连接形成高度特异而精确的环路联系,是神经环路和神经系统发挥功能的基础。调控突触发生、成熟和突触可塑性的分子机制直接与大脑的高级功能如情绪、情感、认知和学习记忆等相关联,而突触丢失和突触功能异常是孤独症 (Autism)、帕金森氏症 (Parkinson's disease, PD) 和阿尔兹海默症 (Alzheimer's disease, AD) 等中枢神经系统疾病发病过程中最早期的病理改变。因此,研究突触发育和突触可塑性的调控机制对于理解大脑的工作原理显得尤为重要。
为了研究PKD1在神经系统发育后期对树突棘形态和突触成熟的调控作用,王韵研究组以原代培养的海马神经元为模型,证明了PKD1作为N-cadherin的上游并通过与N-cadherin的结合和磷酸化来促进突触发育和突触功能,该过程依赖于PKD1的激酶活性。通过构建一系列截短突变体,作者确定了PKD1能够直接与N-cadherin 836-871位的氨基酸结合并磷酸化N-cadherin 869, 871, 872位的丝氨酸,从而增加N-cadherin的膜定位,并促进突触发育和突触功能。作者进一步研究发现,PKD1与N-cadherin的相互作用能够增加其与b-catenin的结合能力,从而稳定N-cadherin的膜定位。通过干扰肽和删除结合区域等手段阻断PKD1与N-cadherin的直接结合,或者将N-cadherin上PKD1的磷酸化位点突变,均导致N-cadherin膜定位减少,并抑制了突触发育和突触功能。为了研究PKD1与N-cadherin的相互作用对发育晚期大鼠海马脑区突触可塑性的调控,作者在发育晚期大鼠海马双侧CA1脑区给予干扰肽分别阻断PKD1和N-cadherin的结合或阻断PKD1对N-cadherin的磷酸化,并对急性脑片的长时程增强(Long term potentiation,LTP)进行诱导和记录。研究表明阻断PKD1与N-cadherin的相互作用使LTP的诱导和维持受到抑制,并使神经元突触前递质释放减少。
该研究揭示了PKD1在神经元发育后期调控树突棘发育和突触功能的新机制,即神经型钙粘素N-cadherin作为PKD1的一个新的底物分子,受到PKD1的多重调控。由于大脑发育过程中,N-cadherin等细胞粘附分子对神经元的靶向定位和突触形成意义重大,而突触的正常发育对神经环路的功能是必需的,因此,该研究为最终揭示突触发育和神经环路形成过程中多样、精确的分子调控机制提供了新思路。
北京大学医学部神经科学研究所讲师岑程和博士生罗丽达是这篇论文的并列第一作者,北京大学医学部神经科学研究所王韵是该论文的通讯作者。该研究得到了国家自然科学基金、中国博士后科学基金、科技部973计划和国家科技支撑计划的资助。