岳伟华课题组Mol Psychiatry报道全基因组关联研究的跨种族分析表明抗精神病药所致体重增加与脂代谢通路障碍关联
不良代谢状态、较高的共病率、不良生活方式、社会经济差异等多种因素造成了精神分裂症患者具有较短的预期寿命。其中,2型糖尿病和冠心病对精神分裂症患者预期寿命缩短起着重要作用[1-2],而这些代谢疾病主要源于抗精神病药物诱导的体重增加(AIWG) [3]。作为治疗精神分裂症的主要药物之一,非典型抗精神病药物在急性治疗期间可能会导致患者发生平均增幅为0.34至3.01 kg的体重增加[4]。此前有研究表明,体重每增加1公斤,发生心血管疾病的概率就会增加3.1%[5]。因此在急性期治疗期间,非典型抗精神病药物所致体重增加会使心血管疾病的发生风险增加约1.05-9.33%。除了体重增加之外,AIWG与抗精神病药物诱导的代谢紊乱时常同时发生,这使得患者的心血管疾病风险进一步提高[6]。介于此,在开始使用抗精神病药物时就预防或干预AIWG尤为重要,但是,AIWG发生的潜在机制目前仍不清楚,大大限制了这一邻域的发展。以往研究表明,AIWG的变异性很大程度上取决于遗传因素[7]。
2024年2月9日,北京大学第六医院、IDG麦戈文脑科学研究所岳伟华课题组,在《Molecular Psychiatry》发表了题为“Genome-wide association study implicates lipid pathway dysfunction in antipsychotic-induced weight gain: multi-ancestry validation”的研究论文[8]。作为迄今为止最大的AIWG全基因组关联研究,该研究揭示了AIWG的发生机制与脂质代谢通路功能失调密切相关,在中国汉族患者中新发现了与AIWG全基因组显著相关的基因座,进一步确定PEPD和PTPRD作为AIWG的潜在致病基因和治疗靶点。该研究首次发现,AIWG和2型糖尿病在PEPD基因区域具有共享的因果遗传变异,而急性期抗精神病药物治疗引发的血脂改变对AIWG的发生具有潜在的因果作用。为了实现患者的风险分层,该研究开发了多基因风险评分并构建预测模型,能够有效预测治疗6个月后AIWG的发生。这项研究为AIWG的发病机制提供了新的见解,有助于精神分裂症的个性化治疗。

作者在中国汉族精神分裂症患者中进行了一项两阶段全基因组关联研究(GWAS),共纳入3100例患者(发现队列:N=1936;验证队列:N=534;跨种族验证CATIE队列:N=630),以确定与AIWG相关的单核苷酸多态性(SNP),随后通过精细定位和功能注释分析探索致病基因。为了确定AIWG的预测指标,作者构建了多基因风险评分并使用孟德尔随机化确定具有因果作用的脂质指标。为了实现精神分裂症个性化治疗,作者结合既往研究发现和本研究新鉴定的预测指标构建AIWG预测模型,并通过药物重定位分析探索AIWG潜在的干预措施。
研究结果发现,位于PEPD的rs10422861和位于PTPRD的rs3824417与AIWG全基因组显著相关 (图1)。
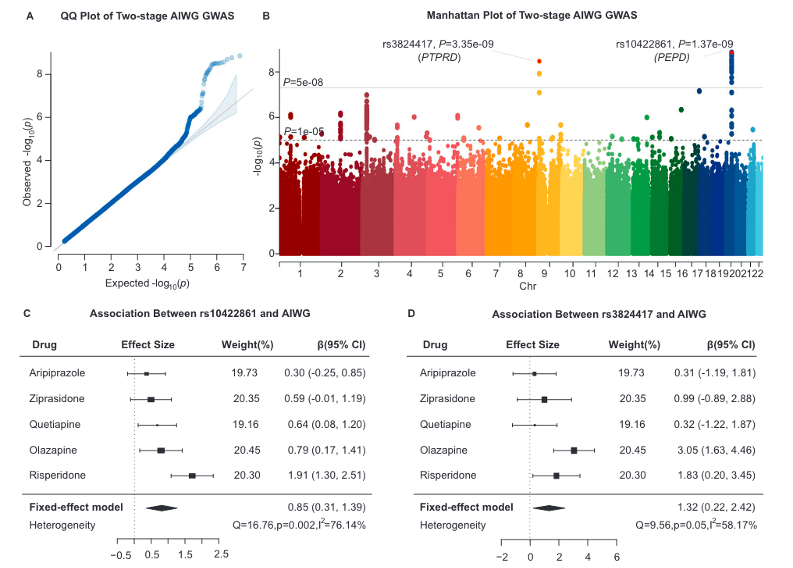
图1
使用FUMA软件将rs10422861和rs3824417定位到脂质相关通路上的基因,具体通路涉及白色和棕色脂肪细胞的分化和调节脂肪形成的转录级联通路。功能注释显示,rs10422861可能通过调节血液和大脑中PEPD基因的多个分子表型来发挥其对AIWG的影响,包括DNAm、RNA水平和选择性多聚腺苷酸化。同时,结果显示与非纯合等位基因携带者相比,rs10422861纯合等位基因携带者( TT )在右侧下丘脑外侧部和右侧小脑之间具有更强的功能连接 (图2)。
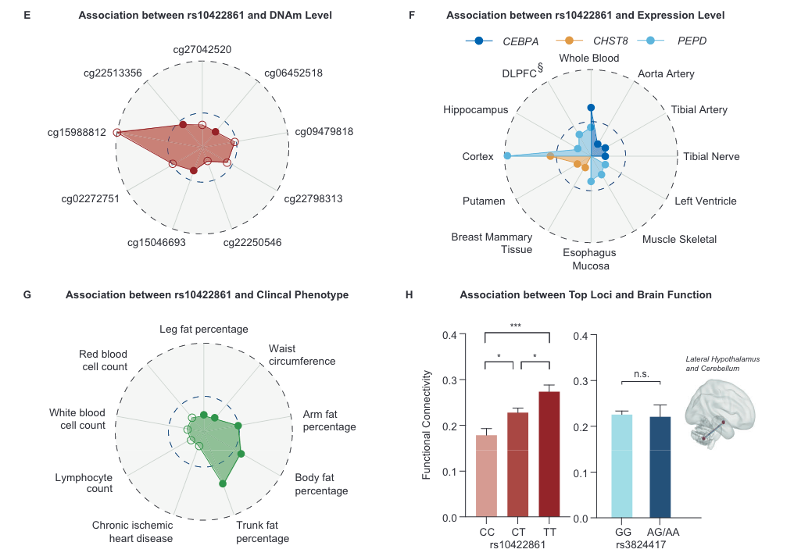
图2
PEPD基因编码脯氨酶,可促进脂肪前细胞增殖和脂肪细胞中AKT2的磷酸化,同时抑制脂肪分解[9],这是一种新提出的引发心脏代谢疾病的机制[10]。PTPRD可能作为神经元细胞粘附分子和突触指示物起作用,并已被确定为下丘脑AgRP神经元中asprosin的促氧受体[11,12]。AgRP神经元中PTPRD的基因消融导致对饮食诱导的肥胖的抵抗。其特点是食欲明显下降,体质消瘦,无法对asprosin的增氧作用作出反应[11]。同时据报道,PTPRD可诱导脂肪细胞分化[13]。
为了确定AIWG的预测指标,作者构建了多基因风险评分,并使用孟德尔随机化(MR)确定具有对AIWG具有因果作用的脂质指标。logistic回归分析的结果提示, AIWG多基因风险评分 (AIWG PRS)和2型糖尿病多基因风险评分(T2D PRS)越高,患者在抗精神病药急性期治疗期间发生AIWG的风险越大。
双向单样本孟德尔随机化分析显示,在接受抗精神病药物治疗期间,患者第4周的低密度脂蛋白的对数转换值每增加一个单位,到第6周时,患者的BMI将增加4.23%;同样,患者第6周的甘油三酯水平的对数转换值每增加一个单位,将导致第6周的BMI增加1.70%;这种因果关系仅在正向MR分析中被发现,而在反向MR分析中并未发现。研究从遗传预测角度出发证实了脂质通路功能障碍与抗精神病药引起的体重增加有关,进一步拓展了与遗传因素相关的抗精神病药物诱导的代谢表型,为进一步的因果关系分析提供了有效的工具变量。
此外,作者在CATIE队列中整合了PRSs以及对AIWG具有因果作用的脂质指标和临床预测因子,构建联合预测模型预测抗精神病药治疗6个月后AIWG的发生。结果表明,联合模型具有良好的校准度以及良好的区分度( AUROC = 0.79,95 % CI : 0.73-0.85 ),且与单纯的临床模型相比,联合模型具有更高的回归性能(交叉验证R2临床模型 = 0.298,交叉验证R2联合模型 = 0.332)。决策曲线分析显示,在10 % ~ 100 %风险阈值范围内,该联合预测模型的临床净获益高于全部或完全没有治疗的策略,表明了其用于精准医学的潜力(图3)。
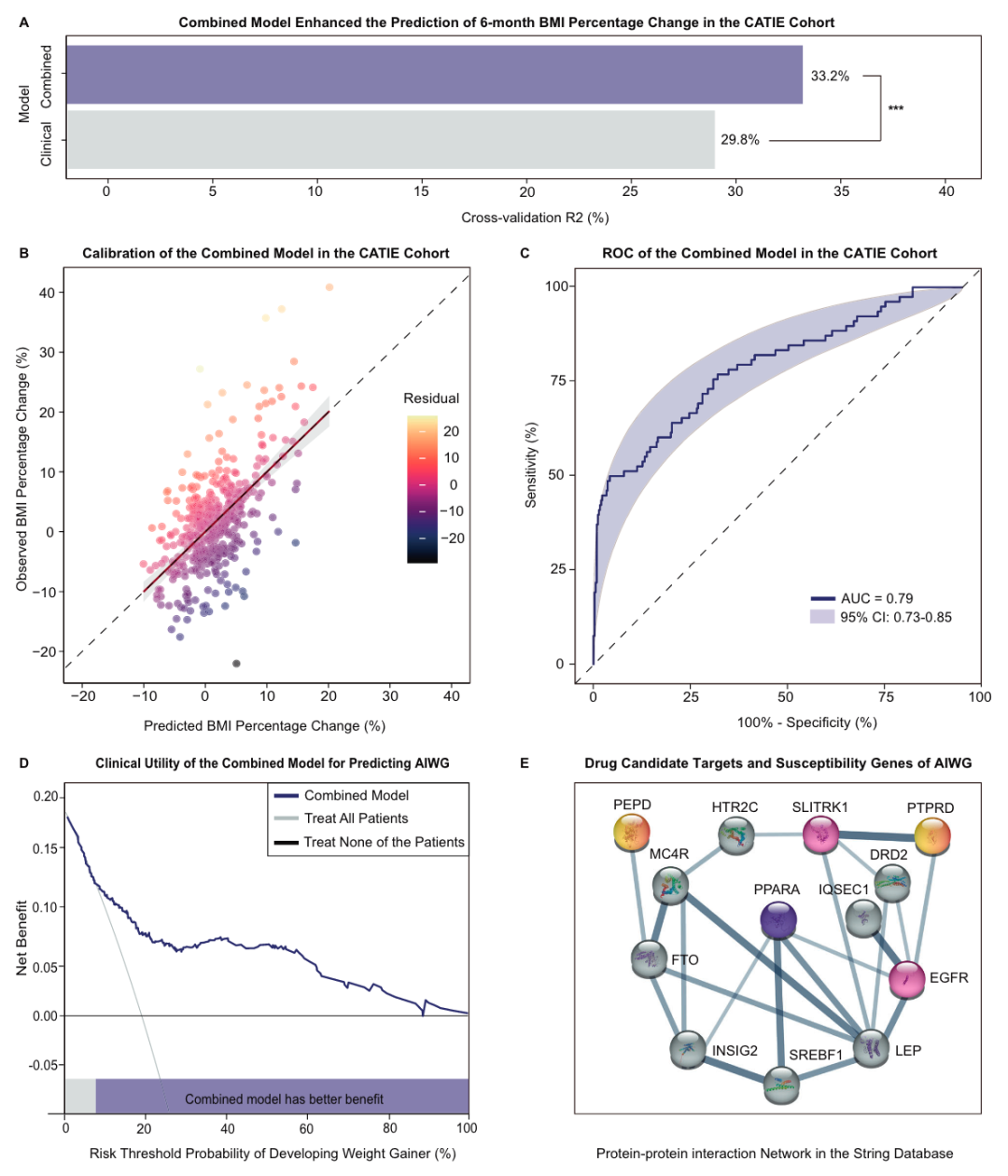
图3
最后,研究发现PEPD和PTPRD是AIWG的药物候选靶点,药物重定位分析提示过氧化物酶体增殖物激活受体α (PPARα)激动剂和甘油三酯合成抑制剂是AIWG的潜在干预措施。蛋白质-蛋白质相互作用网络(PPI)提示,PEPD、PTPRD和PPAR α通过EGFR和SLITRK1与抗精神病药物靶点(DRD2、HTR2C)和先前鉴定的AIWG易感基因(MC4R、LEP、SREBF1、IQSEC1、FTO、INSIG2)编码的蛋白相连接(图3)。
综上所诉,该研究为AIWG的发病机制提供了新的见解,进一步揭示了抗精神病药物和代谢紊乱之间的联系,为精神分裂症治疗过程中存在的代谢紊乱问题提供了重要的解决思路。本文共同第一作者为廖云丹和郁昊,共同通讯作者为岳伟华教授和张于亚楠副研究员。
参考文献
1. Lin J-J, Liang F-W, Li C-Y, Lu T-H. Leading causes of death among decedents with mention of schizophrenia on the death certificates in the United States. Schizophr Res. 2018;197:116–123.
2. Hjorthøj C, Stürup AE, McGrath JJ, Nordentoft M. Years of potential life lost and life expectancy in schizophrenia: a systematic review and meta-analysis. Lancet Psychiatry. 2017;4:295–301.
3. Nielsen RE, Banner J, Jensen SE. Cardiovascular disease in patients with severe mental illness. Nat Rev Cardiol. 2021;18:136–145.
4. Pillinger T, McCutcheon RA, Vano L, Mizuno Y, Arumuham A, Hindley G, et al. Comparative effects of 18 antipsychotics on metabolic function in patients with schizophrenia, predictors of metabolic dysregulation, and association with psychopathology: a systematic review and network meta-analysis. Lancet Psychiatry. 2020;7:64–77.
5. Willett WC, Manson JE, Stampfer MJ, Colditz GA, Rosner B, Speizer FE, et al. Weight, weight change, and coronary heart disease in women. Risk within the ‘normal’ weight range. JAMA. 1995;273:461–465.
6. Grajales D, Ferreira V, Valverde ÁM. Second-Generation Antipsychotics and Dysregulation of Glucose Metabolism: Beyond Weight Gain. Cells. 2019;8:1336.
7. Gebhardt S, Theisen FM, Haberhausen M, Heinzel-Gutenbrunner M, Wehmeier PM, Krieg J-C, et al. Body weight gain induced by atypical antipsychotics: an extension of the monozygotic twin and sib pair study. J Clin Pharm Ther. 2010;35:207–211.
8. Liao Y, Yu H, Zhang Y, Lu Z, Sun Y, et al. Genome-wide association study implicates lipid pathway dysfunction in antipsychotic-induced weight gain: multi-ancestry validation. Mol Psychiatry. 2024 Feb 9.
9. Chen Z, Yu H, Shi X, Warren CR, Lotta LA, Friesen M, et al. Functional Screening of Candidate Causal Genes for Insulin Resistance in Human Preadipocytes and Adipocytes. Circ Res. 2020;126:330–346.
10. Hua Y, Nair S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochim Biophys Acta. 2015;1852:195–208.
11. Mishra I, Xie WR, Bournat JC, He Y, Wang C, Silva ES, et al. Protein tyrosine phosphatase receptor δ serves as the orexigenic asprosin receptor. Cell Metab. 2022;34:549-563.e8.
12. Feng B, Liu H, Mishra I, Duerrschmid C, Gao P, Xu P, et al. Asprosin promotes feeding through SK channel-dependent activation of AgRP neurons. Sci Adv. 2023;9:eabq6718.
13. Chen M, Dong Y, Tian L, Zhou J, Zhu E, Yuan H, et al. Metastasis suppressor 1 interacts with protein tyrosine phosphatase receptor-δ to regulate adipogenesis. FASEB J. 2023;37:e22857.