Liqun Luo: Wiring specificity of neural circuit
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出根据报告内容整理的学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据斯坦福大学骆利群教授所作的题为“Wiring specificity of neural circuit”的学术报告整理而成。

Prof. Liqun Luo
整理:王 纯
审核:毛仁波
大脑是最复杂的器官,人脑包含约1000亿个神经元,每个神经元都有数千个突触连接。那么神经元是如何形成大量的精确连接呢?
骆利群教授以果蝇的嗅觉系统为模型:同一类嗅觉受体神经元(olfactory receptor neuron, ORN)的轴突与嗅觉投射神经元(projection neuron, PN)的树突进行一对一连接(one-to one connections)。而当50类ORN轴突和PN树突到达触角叶(antennal lobe)时,每类神经元依赖于不同的跨膜和分泌蛋白建立种类特异的神经环路模式(class-specific wiring patterns)。例如:Sema-1a(semaphorin-1a)沿着背外侧-腹内轴(the dorsolateral–ventromedial axis)通过细胞自主(cell-autonomously)调控PN树突靶点;Sema-2a/-2b蛋白沿同一轴与Sema-1a梯度形成反梯度,并作为引导这一靶向的细胞外线索;Sema-1a介导ORN-ORN相互作用和Hh(hedgehog) 介导ORN靶标相互作用;Teneurin通过调节Ten-m and Ten-a的水平从而介导 PN 树突和ORN轴突的特异性结合。
骆利群教授及其团队发现teneurin-3(Ten3)在小鼠海马近端cornu ammonis1(CA1),远端下托(subiculum)和内侧内嗅皮层(entorhinal cortex)表达。Teneurin是进化上保守的跨膜蛋白,是脊椎动物视觉系统发育所必需的。通过病毒介导的基因操纵发现近端CA1的轴突投射至远端下托,将CA1的Ten3 敲除后,近端CA1的轴突不仅投射到远端下托还扩散至近端下托,表明Ten3在近端CA1的轴突精准投射到远端下托是必不可少的(图1)。进一步研究表明Ten3以依赖于剪接异构体的方式促进同嗜性粘附(homophilic adhesion)。以上结果表明Ten3可以通过同嗜性吸引(homophilic attraction)来协调哺乳动物大脑中脑回路的组装,揭示了Ten3在哺乳动物神经发育过程中的作用机制。

图1. 在Ten3Het和Ten3KO小鼠的近端 CA1注射PHA-L(绿色)后其轴突在下托中的投射(Berns et al., 2018)
那在不表达Ten3的远端CA1,其神经元的轴突投射到下托是由什么基因控制呢?是否是由在海马中与Ten3互补表达(complementary expression)的基因控制呢?如果是,又是如何形成海马平行网络(parallel hippocampal network)的呢?骆利群教授团队采用基于荧光激活细胞分选的单细胞RNA测序(fluorescence-activated cell sorting–based single-cell RNA sequencing)分析得出latrophilin-2 (Lphn2,一种可结合Teneurins的G蛋白偶联受体)和Ten3在海马CA1、下托和内嗅皮层中互补表达,并通过原位杂交(图2A)和免疫荧光(图2B)再次证明。
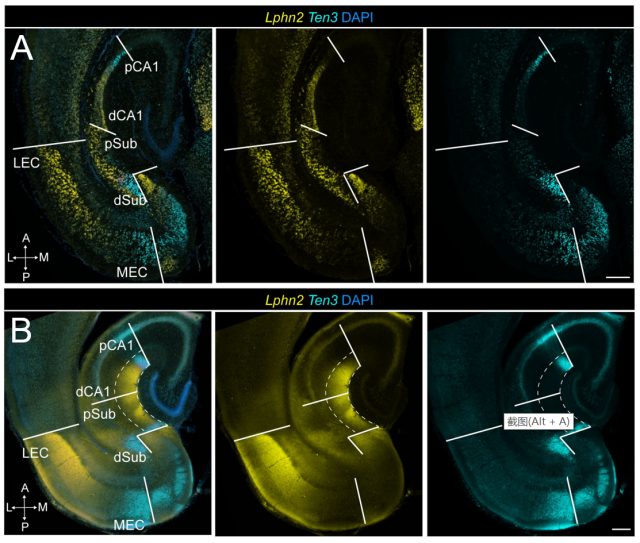
图2. Lphn2和Ten3在P8小鼠海马CA1、下托和内嗅皮层中互补表达(Pederick et al., 2021)
而通过Cre-LoxP系统将CA1的Lphn2敲除,并注射AAV-DIO-mCh追踪Lphn2-null mid-CA1 轴突的投射,发现其投射由近端下托扩散至远端下托,表明Lphn2在中远端CA1轴突投射到近端下托是必不可少的。
通过慢病毒注射在海马远端下托异位表达Lphn2,发现异位表达了Lphn2的小鼠的近端CA1轴突投射到远端下托处的荧光强度减弱,表明下托Lphn2 排斥Ten3+ CA1轴突的投射。为进一步证实以上结论,通过Cre-loxP将下托中Lphn2敲除后近端CA1轴突不仅投射到远端下托还扩散至近端下托,将下托中Ten3敲除后mid-CA1 轴突投射从近端下托扩散至远端下托,表明Ten3与Lphn2相互排斥。
为了排除Lphn2可能是与其它分子相互作用,而不是Ten3,将下托中Lphn2和Ten3双敲除后发现,与单敲除一样,近端CA1轴突投射至远端下托和近端下托,表明Lphn2是与Ten3相互作用,但其投射至远端下托的荧光强度减弱,说明CA1轴突投射到远端下托需要Ten3/Ten3介导的嗜同性吸引。
以上结果表明Ten3和Lphn2在海马近端CA1轴突投射至远端下托,和中远端CA1轴突投射至近端下托中必不可少(图3),且轴突投射的选择需要Ten3/Ten3介导的同嗜性吸引(homophilic attraction)和Ten3/Lphn2介导的异嗜性排斥(heterophilic repulsion)相结合,以确保CA1轴突可以精确投射到下拖中。
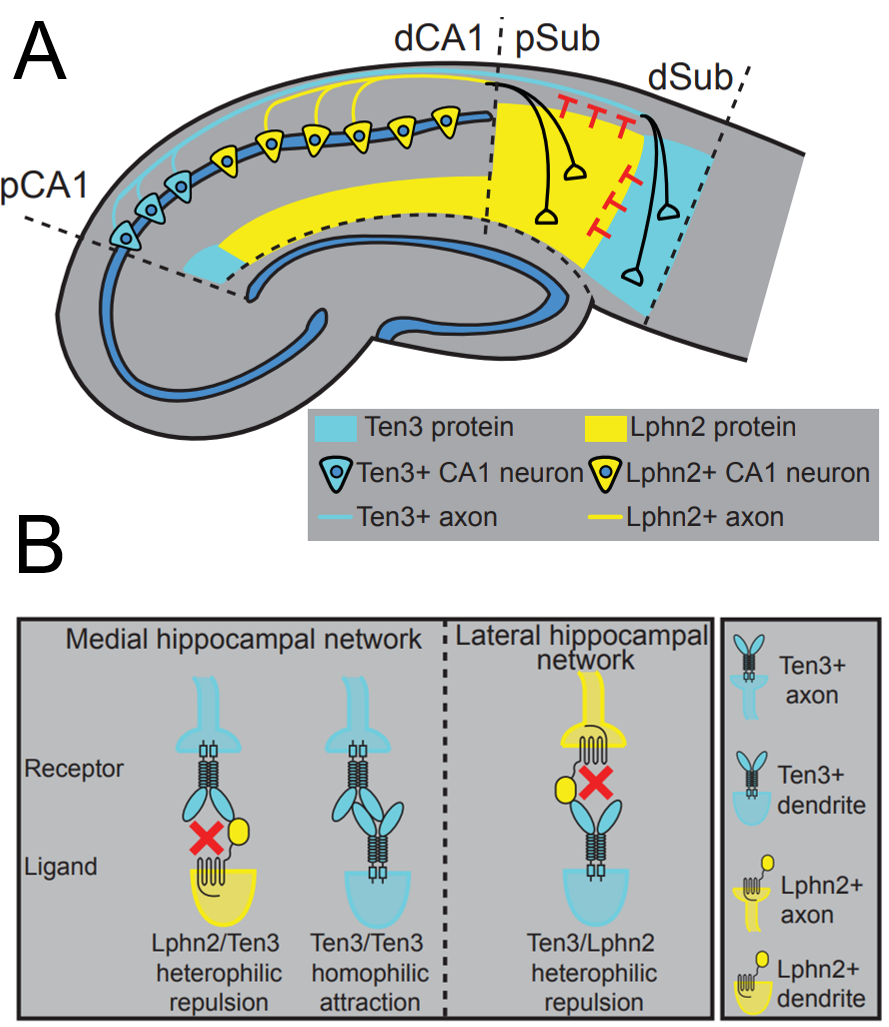
图3. Lphn2和Ten3通过相互排斥指导(instruct)海马轴突靶点的选择(target selection)(Pederick et al., 2021)
骆利群教授的报告以果蝇的嗅觉系统为例,表明神经元的精确连接依赖于细胞表面分子,研究发现小鼠脑内海马区介导神经元精确连接的细胞表面分子及其作用机制,帮助我们更好地理解哺乳动物脑内神经元的精确连接。
参考文献:
Berns, D.S., DeNardo, L.A., Pederick, D.T., and Luo, L. (2018). Teneurin-3 controls topographic circuit assembly in the hippocampus. Nature 554, 328-333.
Pederick, D.T., Lui, J.H., Gingrich, E.C., Xu, C., Wagner, M.J., Liu, Y., He, Z., Quake, S.R., and Luo, L. (2021). Reciprocal repulsions instruct the precise assembly of parallel hippocampal networks. Science (New York, NY) 372, 1068-1073.