Yan Song:Ready, go! Timely and robust cell fate commitment in neural stem cell lineages
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据北京大学生命科学学院、生命科学联合中心宋艳研究员所作的题为“Ready, go! Timely and robust cell fate commitment in neural stem cell lineages”的学术报告整理而成。
Dr. Yan Song
整理:申钰荧
审核:宋 艳
Timeliness is best in all matters. 作为高等动物结构和功能最复杂的系统,神经系统由种类功能繁多的神经细胞组成。神经细胞及时、精准地做出命运决定是保证神经系统正常运转、规避神经发育疾病的分子基础。正如 “准备”和“加速”对顺利完成短跑比赛至关重要,北京大学生命科学学院、生命科学联合中心宋艳研究员提出“提前准备”和“适时加速”是确保神经细胞命运及时锁定的两大策略。
宋艳研究员先以进化上高度保守的同源域 (homeobox) 转录因子Prospero (Pros) 为例。Pros在促进神经元终末分化过程中起着充分且必要的关键作用。通过免疫荧光染色,宋艳课题组意外地发现Pros可以形成小的凝聚体并滞留在果蝇神经前体细胞有丝分裂期染色体上。在分裂期,染色质凝缩形成高度致密的染色体,绝大多数转录因子会从染色体上脱离,为什么Pros蛋白能留在染色体上?Pros的染色体滞留又有何生理学意义?通过系统性筛选、精细的果蝇完整脑荧光动态成像、光遗传学等多种手段,他们找到了对Pros染色体滞留关键的区域N7,并发现Pros蛋白是通过液液相分离植入并保留在分裂期染色体上,从而起到促进神经元分化的作用。
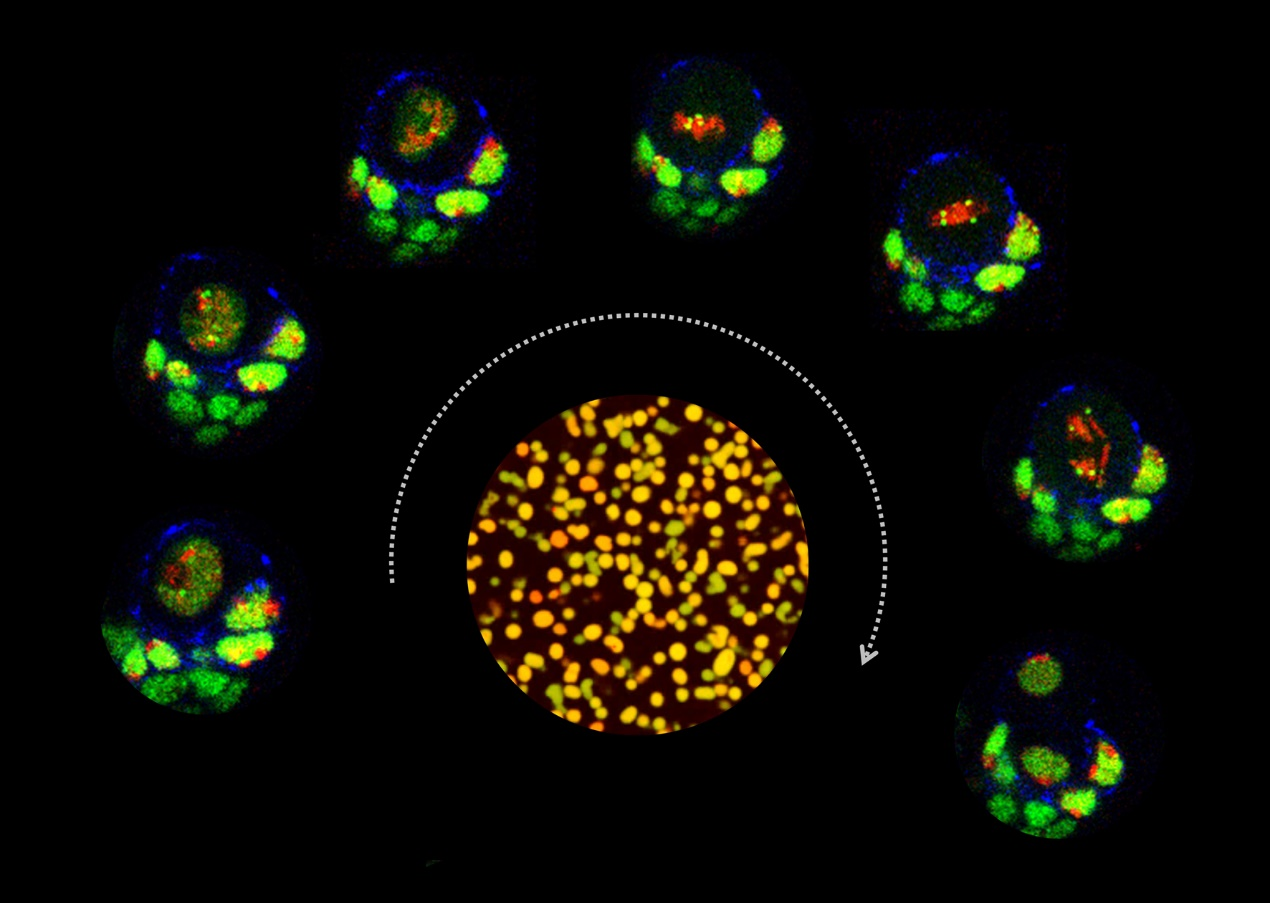
图1. 转录因子液滴的染色体植入驱动神经元及时终末分化。
为什么转录因子Pros需要留在分裂期染色体上来发挥功能?宋艳课题组发现Pros保留在神经前体细胞H3K9me3标记的近着丝粒异染色质区。抑制性组蛋白修饰H3K9me3所标记的异染色质在分化过程中逐渐凝聚,区域扩展,形成防止已分化细胞命运逆转的重要壁垒。但生理条件下分化过程中H3K9me3异染色质凝缩、扩展的分子调控机理尚不明晰,在终末分化的细胞中,异染色质如何调控特定基因的永久沉默更是未解之谜。结合遗传学证据,他们发现Pros可以招募并促进H3K9me3阅读器 HP1a凝聚体的形成。当神经前体细胞进入分裂末期,Pros促进HP1a液滴转变为低流动性的近凝胶状态,从而驱使新生成的神经元中H3K9me3异染色质区域的凝聚和扩展。
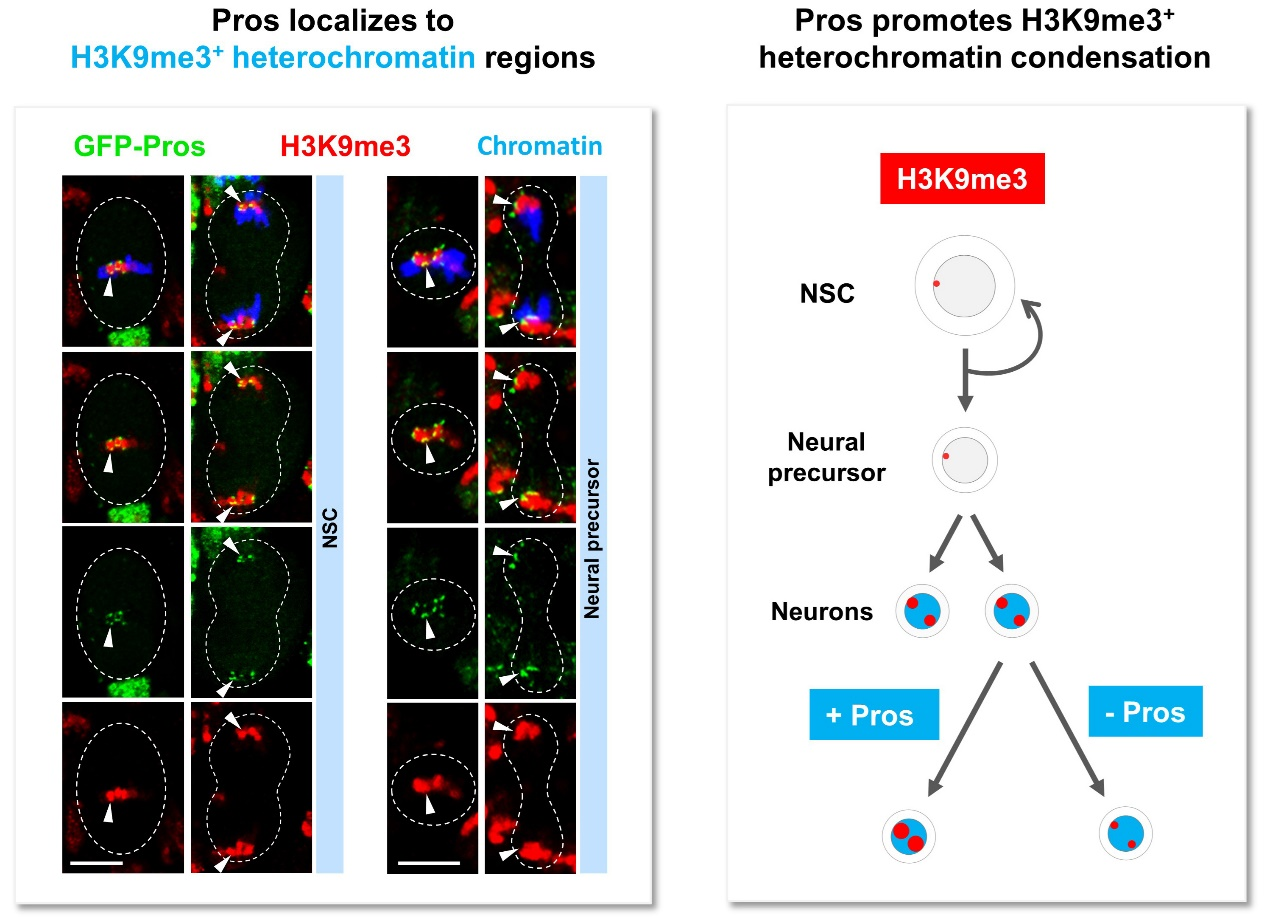
图2. Pros(绿色)保留在神经干细胞和前体细胞H3K9me3标记(红色)的近着丝粒异染色质区,驱使新生成的神经元中H3K9me3标记的异染色质区域的凝聚和扩展。(Liu X#, Shen J#, et al., 2020)
DamID-seq、DNA FISH等结果表明,当前体细胞分裂产生两个神经元时,Pros从H3K9me3标记的异染色质区域解离,同时携带一部分HP1a到其与细胞自我复制和细胞周期相关的关键靶基因,介导靶基因所在区域的局部凝缩,达到沉默靶基因的目的。另外,这些局部凝缩的位点还可能通过HP1a介导的液滴融合与富含HP1a的异染色质区靠近,进一步促使这些关键基因的永久沉默,确保神经元的终末分化。因此,通过染色体植入的方式在分裂之前“提前准备”是确保神经元及时终末分化的一种有效策略。有意思的是,该策略也在哺乳动物神经发育过程中被使用。宋艳课题组未发表的工作表明在小鼠脑中,Prox1通过依赖于其 IDR的方式形成凝聚体并滞留在分裂期染色体上;功能上,删去IDR的Prox1丧失了促分化的能力,而回补IDR能够回补该能力。
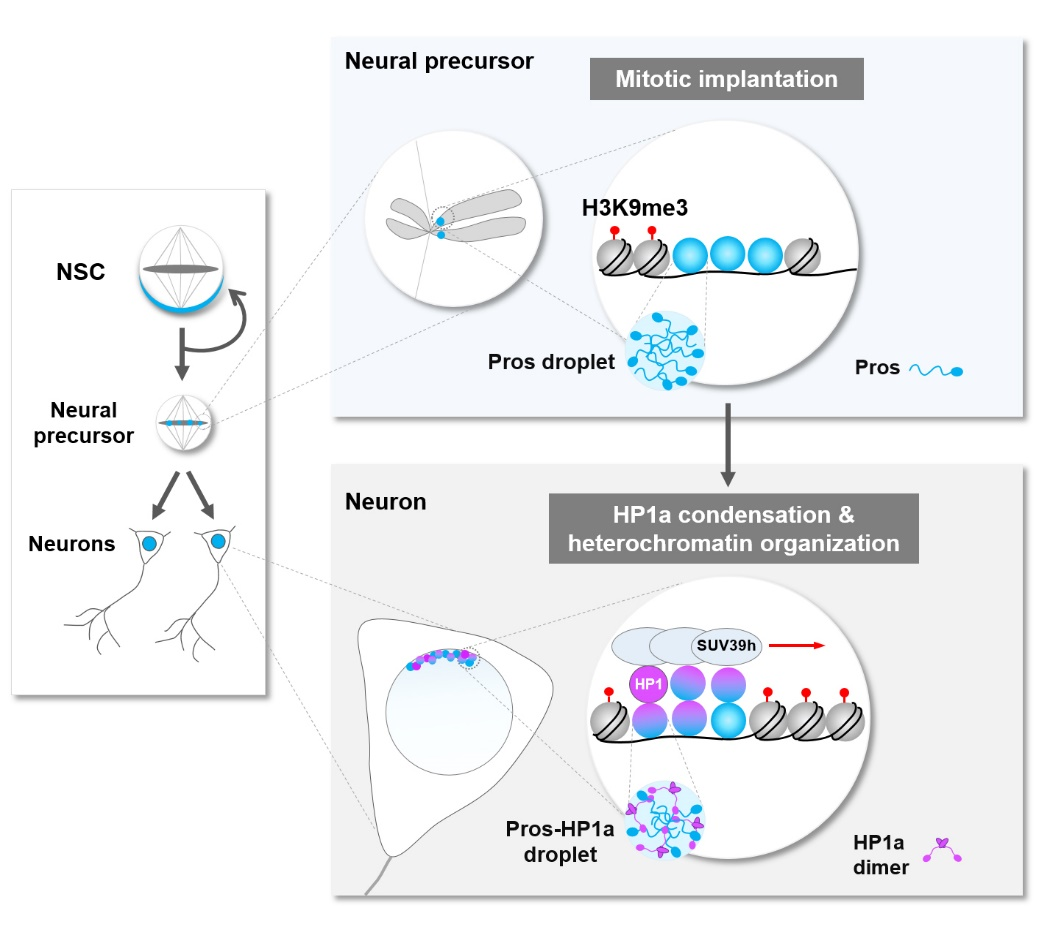
图3. Pros通过液-液相分离“植入”神经前体细胞有丝分裂期染色体,通过促进H3K9me3标记的异染色质区域的凝聚,促使其与细胞自我复制相关的关键靶基因的永久沉默,进而确保新生神经元的及时终末分化。(Liu X#, Shen J#, et al., 2020)
除了神经元终末分化过程,神经干细胞维持原有的身份也会使用“提前准备”这一策略:当干细胞进入分裂期,大多对维持其身份重要的转录因子从染色体剥离,给神经干细胞的命运维持带来挑战。宋艳课题组未发表的工作发现有些转录因子可以在被特异磷酸化修饰后滞留在干细胞分裂期染色体上。作为有丝分裂书签,被留下的转录因子在细胞分裂结束后迅速开启与维持干细胞身份密切相关的靶基因的表达,从而及时、精确地维持神经干细胞的命运。
神经细胞不但可以聪明地“提前准备”来确保正确的细胞命运,还能够在关键的时间点“加速”,保障做出快速、及时和准确的决策。宋艳课题组发现神经干细胞不对称分裂最初产生的两个子细胞间仅有微弱的Notch信号活性差异,需要经过一个快速放大的阶段才能被最终锁定为两个截然不同的子细胞命运。超级转录延伸复合体(SEC)通过在神经干细胞中特异表达并与Notch形成正反馈环路,作为“信号放大器”加速这个由细胞命运决定至锁定的过程,迅速放大两个子细胞间短暂而微弱的Notch信号活性差异,从而稳固且不可逆地锁定神经干细胞与祖细胞这两个截然不同的子细胞命运。因此,“适时加速”是驱动神经干细胞命运及时锁定的另一重要策略。
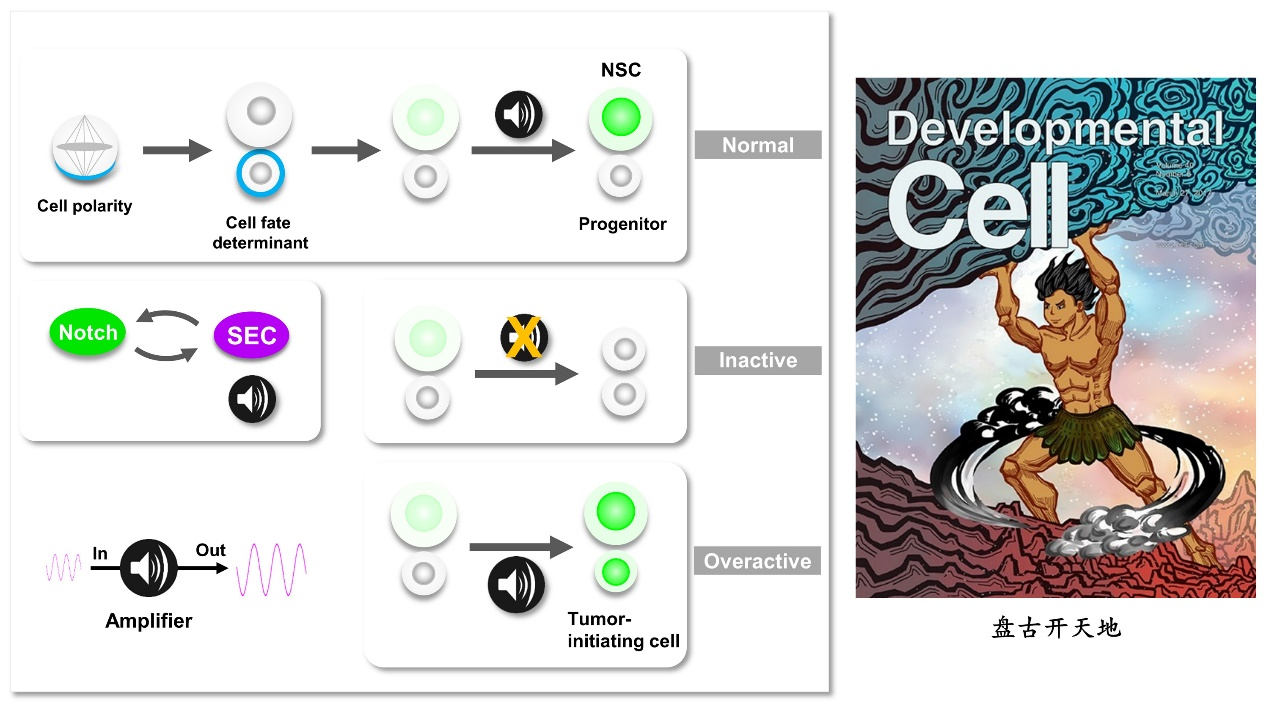
图4. 超级转录延伸复合体SEC通过在神经干细胞中与Notch信号形成正反馈环路,作为“信号放大器”快速放大子细胞间的微小差别,加速细胞命运由决定至锁定的过程,驱动神经干细胞命运的及时锁定。(Liu K et al., 2017)
总之,宋艳研究员介绍了确保神经细胞命运“及时”锁定的有趣机制:转录因子通过有丝分裂书签或者有丝分裂植入,形成凝聚体留在分裂期的染色体上,来帮助细胞在分裂前“提前准备”;待分裂完成,通过内在的“信号放大器”把初生子细胞间微小的细胞命运差异迅速放大,“加速”命运决定过程,最终完成细胞命运的及时固化和锁定。
