Yang Dan: Motor & sleep control - A tale of two circuits
2021年11月6至7日,北京大学IDG麦戈文脑科学研究所成立十周年庆典暨北京大学脑科学国际论坛成功举办。来自美国哈佛大学、斯坦福大学、加州大学伯克利分校、英国伦敦大学学院、德国马普研究所、日本筑波大学、北京师范大学、中科院脑智卓越创新中心等国内外高校和科研机构的知名学者,从分子、细胞、环路、系统、认知、心理、计算、神经精神疾病等多个层面和角度,热情分享了他们在脑科学前沿研究的最新进展,并与线上线下观众频繁互动,在思维的碰撞中激荡出创新的火花。现陆续推出相关学术笔记,让我们重温精彩再出发!
本期推出的学术笔记,根据加州大学伯克利分校丹扬教授所作的题为“Motor & sleep control - A tale of two circuits”的学术报告整理而成。她分三个部分讲述了对大脑睡眠调控神经环路的一些研究发现。

丹扬教授作学术报告并在线交流
整理:王 蕾
审核:李毓龙
睡眠是动物保守的本能行为,从低等动物水螅,水母到哺乳动物都会睡眠。在非哺乳动物中,睡眠是通过静止行为的延长和唤醒阈值的提高来确定的,而对于哺乳动物,则通常可以通过对肌电图(EMG)和脑电图(EEG)的记录来确认睡眠状态。在人类睡眠研究中也会进行自主神经活动的测量,睡眠和觉醒状态与不同的心率、呼吸和体温也有着紧密的关联。在哺乳动物中,人们发现多个单胺能、胆碱能和肽能神经元系统能够促进觉醒,但对促睡眠的神经环路依然知之甚少。除了早期被发现的睡眠中心——下丘脑视前区(Preoptic area,POA),研究人员在其它脑区也陆续发现了与睡眠相关的神经元,表明哺乳动物中的睡眠行为或许受分布广泛的神经网络调控。为理解睡眠觉醒的机制,对调控睡眠的环路有一个全面的认识,寻找相关神经元是一个重要的研究步骤。
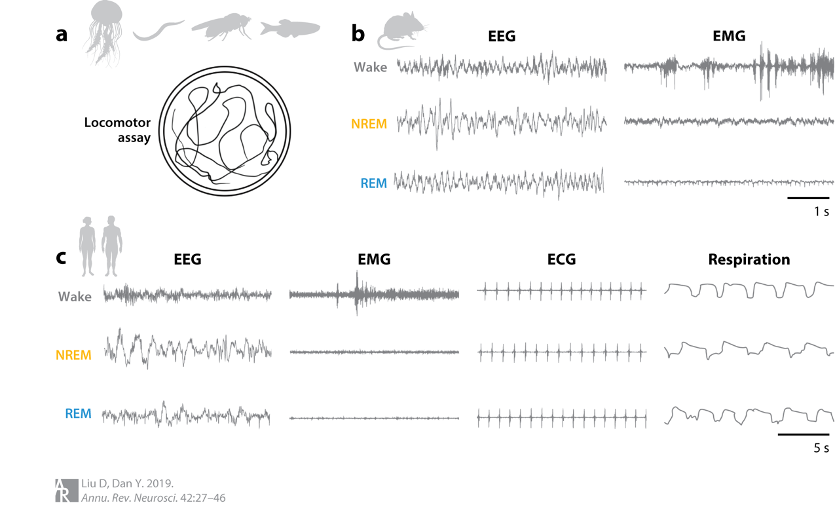
图一. 对不同模式动物以及人类的睡眠记录(Liu, D. & Dan, Y. 2019)
睡眠神经元的特点应该是在睡眠期间活跃,而且睡眠神经元的激活可以促进睡眠状态。从这两个特点出发,丹扬教授通过两种策略在全脑层面对睡眠相关神经元进行了筛选。第一,寻找睡眠期间活跃的神经元,并检验它是否会促进睡眠。在第一部分介绍的研究中,丹扬课题组通过FosTRAP/活动依赖标记的方法,利用FosTRAP(Fos-CreER::LSL-eGFP-L10a)小鼠可以特异标记相关活跃神经元的方法,对比了睡眠剥夺和恢复睡眠之后的小鼠不同脑区的GFP阳性神经元数目,筛选了在睡眠时活跃的神经元。筛选发现在腹侧中脑导水管周围灰质(vPAG)中有一群在睡眠状态中活跃的神经元。RNA测序表明这群神经元普遍表达CALCA,即降钙素基因相关肽alpha。通过光电极(Optrode)记录的方式,他们确认了相较于清醒态(Wake)和快速眼动睡眠(REM),这群CALCA+神经元在非快速眼动睡眠(NREM)中最为活跃。并且,在使用光遗传或化学遗传激活CALCA+神经元时,NREM睡眠发生的概率会增加,而抑制CALCA+神经元则会降低NREM睡眠,表明这群神经元的活动有促进NREM睡眠的作用,符合“睡眠神经元”的两个判断标准。除了CALCA标记的神经元,丹扬课题组在vPAG中还找到了另外几组表达胆囊收缩素(Cholecystokinin,CCK)或神经降压素(Neurotensin,NTS)等的神经元,也会促进NREM睡眠。这些睡眠神经元都属于兴奋性谷氨酸能神经元,它们投射到包括POA在内的多个含有抑制性GABA能促睡眠神经元的脑区,继而间接性地抑制了多群已知的促觉醒神经元,执行其促睡眠的功能,使得vPAG成为了一个兴奋性睡眠中枢。
接下来在第二部分报告的内容中,丹扬教授介绍了使用另一种策略来鉴别睡眠神经元的研究结果,即通过对已知的觉醒神经元进行逆行示踪,找出上一级神经元中是抑制性GABA能的神经元,并对这些神经元再逆行示踪,找出作用于他们的兴奋性谷氨酸能神经元。通过这一策略,丹扬课题组寻找出了多个提供抑制性投射的上游脑区,其中一个重要区域是中央杏仁核(Central amygdala, CeA),其中表达神经降压素的多个神经元亚群会促进NREM睡眠,并且该神经元在NREM睡眠期间也高度活跃。随后他们也发现,神经降压素普遍存在于多种睡眠神经元中,神经肽本身也在NREM睡眠中起了重要作用。
另一个丹扬教授着重阐述的是被筛选出的黑质网状部(Substantia nigra,SNr),这一脑区腹侧是谷氨酸脱羧酶2(Glutamate decarboxylase 2, GAD2)阳性神经元,而背侧的是小清蛋白(Parvalbumin, PV)阳性神经元。黑质网状部最为人熟知的功能是参与运动控制,为了解答为何运动控制神经元会参与调控睡眠,丹扬课题组首先利用深度学习算法,通过脑电图、肌电图和视频记录去刻画小鼠自然行为中的运动状态和大脑状态,并且将小鼠行为划分为位移活动(Locomotion)、无位移活动(Non-locomotor movement)、安静觉醒(Quiet wakefulness)和睡眠(Sleep),这四种具有不同觉醒和运动水平的行为状态。他们发现在位移活动和无位移活动状态时,PV阳性神经元更加活跃;而在睡眠时则是GAD2阳性神经元活动最高。对这两群神经元进行光激活时,PV神经元对睡眠几乎没有影响,GAD2神经元的激活则会降低小鼠活动、增加睡眠状态。抑制GAD2神经元时睡眠大幅下降,活动状态增加,抑制PV神经元依旧对睡眠没有明显影响。所以在SNr是GAD2神经元而非PV神经元,同时具有促睡眠和睡眠时活跃两种特性。有趣的是,通过顺行示踪病毒标记,他们还发现GAD2神经元除了会投射向一些运动控制脑区外,还投射向多个调节大脑状态的区域,如中缝背核(Dorsal raphe,DR)、蓝斑核(Locus coeruleus,LC)和腹侧被盖区(Ventral tegmental area,VTA),每个SNr的GAD2神经元将轴突侧支同时投射向这些不同的脑区,参与运动与大脑状态的调控。从SNr再向上回溯到丘脑底核(Subthalamic nucleus,STN),丘脑底核中的谷氨酸能神经元会激活SNr,也是潜在的促睡眠神经元。除谷氨酸外,STN会同时释放神经降压素,激活这群表达神经降压素的STN神经元,确实可以观察到NREM睡眠的上升。
最后,丹扬教授介绍了在心血管压力中枢对睡眠的调节的研究。大脑延髓灰质的孤束核(Nucleus tractus solitarii,NST)是重要的心血管压力调控中枢。NST下游支配两条路径,其中一条从孤束核投射向尾端腹外侧延髓(Caudal ventrolateral medulla,CVLM),CVLM脑区的抑制性神经元继续投向喙端腹外侧延髓(Rostral ventrolateral medulla,RVLM)脑区,而RVLM区域的肾上腺素能神经元属于交感神经元,会投射向脊髓并通过调节血管平滑肌使血管收缩;另一条路径上,孤束核的下游是胆碱能副交感神经元所在的疑核(Ambiguous nucleus,Amb),Amb直接投射向心脏,通过降低心率来降低血压。再次通过FosTRAP/活动依赖标记的方法,丹扬课题组在孤束核内标记到了一群在血压上升心率下降时活跃的神经元,其中一个亚群的放电活动与心率和血压有极大关联性,提示了这个亚群神经元可能对血压随心跳的周期性改变十分敏感。当光激活这群神经元时,能立刻观察到血压和心率的大幅下降,以及NREM睡眠的增加。当直接激活连接交感神经回路的孤束核的下游CVLM区域,或直接抑制更下游的RVLM时,同样能看到NREM睡眠的增加。相反,如果抑制CVLM或激活RVLM区域,则会观察到NREM睡眠的减少。在另一条副交感神经所参与的环路上,当使用化学遗传学的方式激活Amb,也会在心率下降的同时观察到NREM睡眠的增加。发现调控心血管的中枢同时参与睡眠调节。
除了以上详细介绍的几种睡眠神经元,丹扬组以及其他课题组还在躯体感觉网络中的丘脑、纹状体、杏仁核等脑区,和自主神经网络相关的杏仁核、下丘脑等脑区,都找到了睡眠相关神经元。

图二. 促觉醒、促进NREM睡眠、和促进REM睡眠的神经元总结。(Liu, D. & Dan, Y. 2019)
综上,睡眠和觉醒伴随着大脑状态和身体以及自主运动状态的变化,丹扬课题组发现睡眠神经元分布十分广泛,渗透于觉醒系统、自主神经网络和躯体运动神经网络的节点中,通过轴突侧支同时投射向不同功能的脑区来协调觉醒和运动,产生整体的睡眠状态。这些研究极大帮助了人们更系统地理解睡眠调控机制。
参考文献
1. Chung, S. et al. Identification of Preoptic Sleep Neurons Using Retrograde Labeling and Gene Profiling. Nature 545, 477–481 (2017).
2. Zhang, Z. et al. An Excitatory Circuit in the Perioculomotor Midbrain for Non-REM Sleep Control. Cell 177, 1293-1307.e16 (2019).
3. Liu, D. & Dan, Y. A Motor Theory of Sleep-Wake Control: Arousal-Action Circuit. Annu. Rev. Neurosci. 42, 27–46 (2019).
4. Liu, D. et al. A common hub for sleep and motor control in the substantia nigra. Science 367, 440–445 (2020).