Christophe Leterrier:The axonal cytoskeleton at the nanoscale
4月22日,北京大学IDG麦戈文脑科学研究所举行2022年脑科学研讨会。来自美国布朗大学、加州大学戴维斯分校、杜克大学、凯斯西储大学,法国艾克斯-马赛大学和中国科学院大学等国内外高校的六位脑科学学者,在线作了精彩的学术报告,并与观众互动交流。
本期推出的学术笔记,根据法国艾克斯-马赛大学(Aix-Marseille Université)Christophe Leterrier博士所作的题为“The axonal cytoskeleton at the nanoscale”的学术报告整理而成。
报告主体:Christophe Leterrier博士首先介绍了神经元的基本结构,强调了神经元通过区室化以维持其功能上的极性,其中神经元的轴突本身也是分区的,包括了轴突主干(Shaft),轴突起始节(Axon initial segment, AIS)、突触前末梢(Presynaptic bouton),以及在发育过程中的神经元上存在的生长锥(Growth cone)。他认为这是通过轴突特殊的细胞骨架来实现对结构的建立,维持和转化,因此他们尝试去理解轴突细胞骨架的组织方式,并解释其独特的细胞和生理功能。接下来他讲述了如何观察细胞骨架,提出了技术的发展对于观察微观的细胞骨架发挥了非常重要的作用。
Christophe Leterrier博士首先介绍了使用荧光光学显微镜观察细胞骨架的发展历史。1978年,Marchisio等人首次使用抗微管蛋白和肌动蛋白的抗体标记了神经母细胞瘤细胞过程中的微管和肌动蛋白丝,揭示了微管沿神经突的组织和生长锥内的肌动蛋白网络(Marchisio et al., 1978)。与微管蛋白免疫标记相比,微管相关蛋白MAP2对生长突细胞室的限制在1986年被首次证明(Caceres et al., 1986)。到20世纪90年代末,固定和染色方案才基本完善,使用荧光鬼笔环肽(Phalloidin)、抗微管蛋白和MAP2抗体作为标准标记(Allison et al., 2000)。
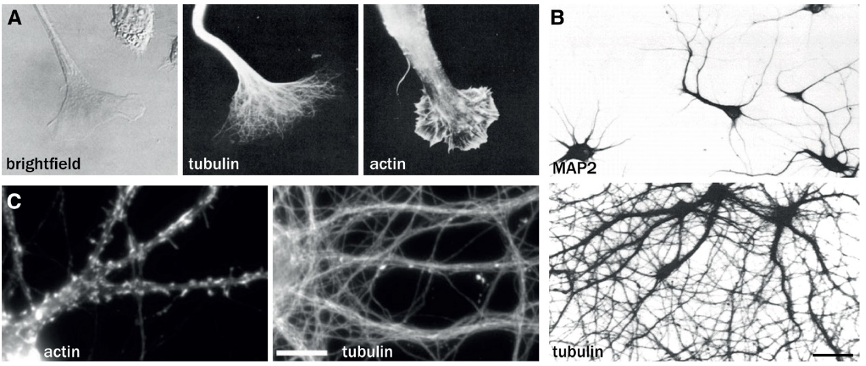
图1. 利用免疫标记可视化神经元细胞骨架
随后Christophe Leterrier提出了关于细胞骨架研究的第一个问题:结合光学荧光标记来观察细胞骨架上的特定微小结构时,分辨率会受到限制。一方面,光学显微镜受限于光的衍射效应,存在分辨率极限,使得我们无法通过光学显微镜观察到200 nm以下微观结构;另一方面,成像需要通过探测器或照相机等成像系统实现,根据点扩展函数(point spread function, PSF),即使小于1 nm的分子在成像系统中也只能达到200 nm。因此,当他试图观察神经元的细节时,这些区域不仅像素化了,而且很模糊,大小和点扩散函数差不多,导致无法获取这些区域内的细节。
对此,他提出了应对的方案,介绍了一套完善的技术,称为集合超分辨率显微技术(Collectively super resolution microscopy),通过这种技术可以绕过分辨率的限制,更清晰地观察神经元细胞骨架的组织。这套技术包括(1)单分子定位显微技术(single-molecule localization microscopy, SMLM),这是一种使用单个荧光发射体顺序定位的方法,具体涉及到随机光学重建显微镜(stochastic optical reconstruction microscopy, STORM)、光激活定位显微技术(photo-activation localization microscopy, PALM)和纳米尺度形貌DNA点积累(point accumulation in nanoscale topography, PAINT)等技术;(2)结构光照明显微成像(Structure Illumination Microscopy, SIM),它能够检索超出衍射极限的细节使用;(3)受激辐射损耗显微技术(stimulated emission depletion microscopy, STED),一种点扫描技术等等。
接下来,他介绍了借助这套技术是如何实现观察神经细胞骨架的,其中他们主要关注轴突中的细胞骨架结构,并围绕一种沿轴突周期性排列的actin/spectrin亚膜支架结构以及clathrin packets展开。
通过这套技术,研究揭示了轴突中一个全新的细胞骨架组织,一种沿轴突周期性排列的actin/spectrin亚膜支架结构。在果蝇中进行的SIM观察报告了一种亚膜支架蛋白锚蛋白,沿轴突轴形成了~200 nm间距的规律排布(图2A, Pielage et al., 2008)。2013年,在培养的神经元和器官类型切片中,利用优化的STORM技术,发现肌动蛋白沿轴突形成环,每隔190nm排列整齐(图2B, Xu et al., 2013)。肌动蛋白环沿所有轴突分布,包括有髓鞘的轴突(图2C, D’Este et al., 2016)。在此基础上,Christophe Leterrier利用双色SMLM(2-color SMLM),观察到肌动蛋白形成的相隔190nm排列的环状结构与连接相邻环的spectrin四聚体的长度相匹配,形成一个周期性的亚膜支架,在双色SMLM图像上显示为spectrin和actin的交变带(图2D)。Christophe Leterrier结合铂复制电镜(platinum replica EM)技术,并且在机械切除细胞的背侧部分后,可以观察到,神经元的去除背侧的轴突中由亚膜结构网连接的有规则间隔的三维的肌动蛋白“辫子状”的环(图3)。他还利用了相关的超分辨率成像和电子显微镜(Correlative SMLM/PREM),这两种技术所提供的纳米级精度使SMLM图像和PREM视图能够紧密匹配,证实了铂复制电子显微镜(platinum replica EM)所显示的肌动蛋白“辫子”确实是STORM所显示的肌动蛋白环(图4)。
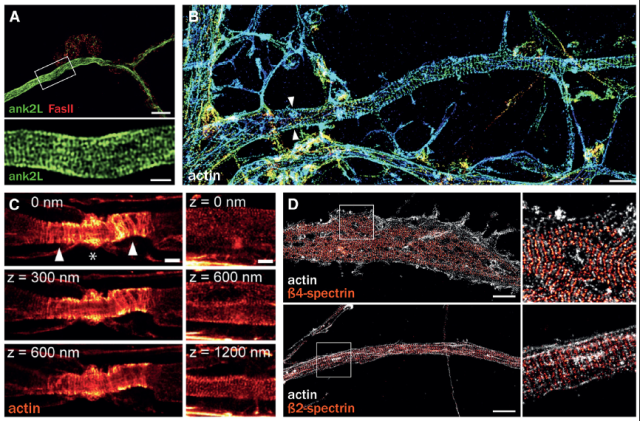
图2. 沿轴突周期性排列的actin/spectrin亚膜支架
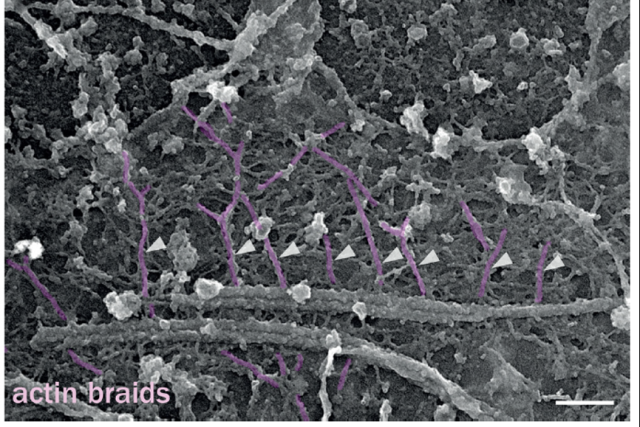
图3. platinum replica EM下的无顶培养的海马神经元,箭头所指为actin braids

图4. Correlative SMLM/PREM resolves the ultrastructure of actin rings
Christophe Leterrier另一个关注的结构则是网格蛋白(clathrin)。许多研究表明,在非神经元细胞中,网格蛋白已经确定了其在胞吞作用中的作用,网格蛋白笼将质膜包裹起来,随后是单体的快速分解和再利用。然而,在神经元中,网格蛋白在数天至数周的缓慢轴突运输中被传递,其潜在的运输/靶向机制、可移动的货物结构,甚至其精确的突触前定位和生理作用都不清楚。他通过免疫染色观察神经元中的网格蛋白,尽管培养的神经元中点状网格蛋白在生长突和轴突间室的整体外观看起来相似(图5A),但它们的动力学却不同。在细胞体以及树突中,标记网格蛋白的荧光信号的突然出现和消失(红色箭头),反应了内陷小窝(coated pits)中网格蛋白的组装/拆卸(图5B),而在轴突中网格蛋白以相对稳定的形式存在,且其中部分网格蛋白表现为整体具有顺行倾向的移动(图5C)。
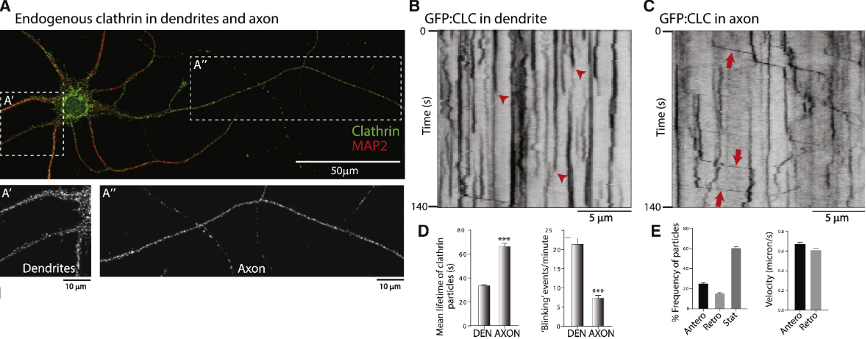
图5. 网格蛋白在树突和轴突中的动力学差异
有假说认为,网格蛋白会形成网格蛋白包(clathrin packets),并且这种网格蛋白包会沿着轴突运输到突触前末端。他使用DNA-PAINT,一种基于单分子的超分辨率显微镜技术来可视化内源性网格蛋白沿轴突的纳米级组织(图5)。通过可视化β2-spectrin来确定轴突边界,β2-spectrin是亚膜周期性轴突支架的一种成分,与其他成像方式不同,DNA-PAINT使他能够可视化和表征大量轴突网格蛋白结构。从网格蛋白和β2-spectrin的3D多色DNA-PAINT图像中,还可以生成轴突网格蛋白颗粒的分割和测量的3D渲染图(图6)。通过超分辨率成像观察后,发现的确存在这种网格蛋白包,大小约为100nm,并且不与质膜相连。

图6. 轴突网格蛋白传输包的超微结构和超分辨率成像
Christophe Leterrier之后尝试观察了网格蛋白沿着轴突的运输,通过Live-cell spinning-disk实验,他们的确观察到网格蛋白在神经元上的运输,但是分辨率的限制,他们无法观察到单个网格蛋白小窝(clathrin coated pits),因为在神经元中,网格蛋白小窝与网格蛋白转运包(clathrin transport packets)彼此十分接近。他结合SoRa超分辨率成像和深度学习实现了跟高分辨率的成像,在这种情况下,他们甚至可以看到质膜的细节,每个网格蛋白的具体结构也变得十分清晰,进而观察到单个网格蛋白的动态变化,并且可以确定它们是网格蛋白小窝还是沿着轴突运输肌动蛋白的网格蛋白运输包(图7)。除此以外,他还使用用结构光照明显微成像(Structure Illumination Microscopy, SIM),得到了更高的分辨率,虽然过程比较耗时,但可以拍摄出更好的图像。
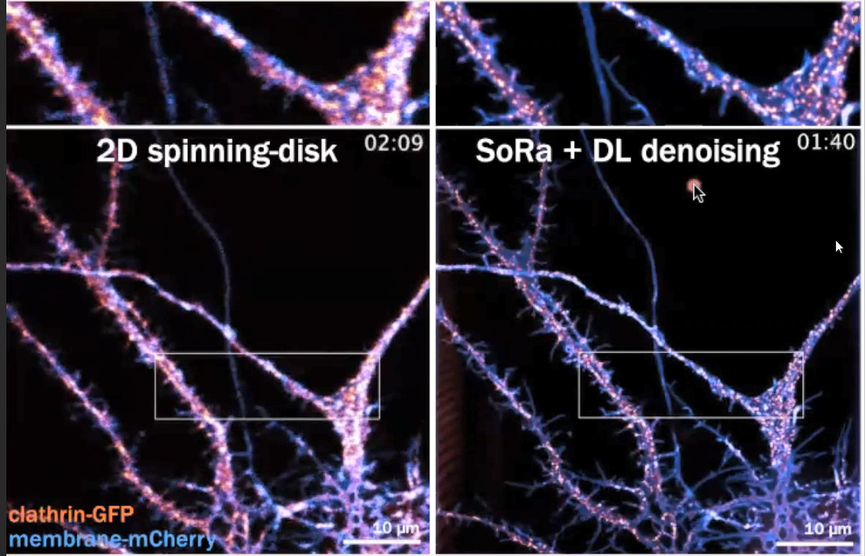
图7. 二维转盘共聚焦成像与结合了深度学习算法的SoRa超分辨率成像结果
撰稿:郑弘熙;审核:张 研
参考文献
1. Leterrier C. A Pictorial History of the Neuronal Cytoskeleton. J Neurosci. 2021 Jan 6;41(1):11-27.
2. van Loon AP, Erofeev IS, Goryachev AB, Sagasti A. Stochastic contraction of myosin minifilaments drives evolution of microridge protrusion patterns in epithelial cells. Mol Biol Cell. 2021 Aug 1;32(16):1501-1513.
3. Vassilopoulos S, Gibaud S, Jimenez A, Caillol G, Leterrier C. Ultrastructure of the axonal periodic scaffold reveals a braid-like organization of actin rings. Nat Commun. 2019 Dec 20;10(1):5803.
4. Ganguly A, Sharma R, Boyer NP, Wernert F, Phan S, Boassa D, Parra L, Das U, Caillol G, Han X, Yates JR 3rd, Ellisman MH, Leterrier C, Roy S. Clathrin packets move in slow axonal transport and deliver functional payloads to synapses. Neuron. 2021 Sep 15;109(18):2884-2901.e7.