Lin Mei: Neuregulin 1 and ErbB4 signaling in synaptic plasticity and pain sensation
4月22日,北京大学IDG麦戈文脑科学研究所举行2022年脑科学研讨会。来自美国布朗大学、加州大学戴维斯分校、杜克大学、凯斯西储大学,法国艾克斯-马赛大学和中国科学院大学等国内外高校的六位脑科学学者,在线作了精彩的学术报告,并与观众互动交流。
本期推出的学术笔记,根据美国凯斯西储大学(Case Western Reserve University)梅林教授所作的题为"Neuregulin 1 and ErbB4 signaling in synaptic plasticity and pain sensation"的学术报告整理而成。
中间神经元约占大脑神经元总数的15-20%,参与维持脑内兴奋/抑制平衡(E/I 平衡),调节锥体神经元的放电。中间神经元可以通过去抑制、前馈和反馈抑制等机制实现对大脑活动的调节。但是,锥体神经元是否也可以通过某些信号通路调控大脑活动呢?梅林实验室的研究结果解答了这一问题,他们的研究结果表明:锥体神经元可以通过Neuregulin1 (NRG1)/ErbB4信号通路调控大脑稳态平衡,且该通路在突触可塑性和热痛觉感知中也发挥重要作用。
一、 NRG1/ErbB4参与调控大脑的稳态平衡
过去20年间,梅林实验室一直致力于NRG1分子及其相关信号通路的研究。NRG1是神经营养因子家族中的一员,可结合并激活ErbB4受体酪氨酸激酶[1],并向下游传递信号。梅林实验室的既往研究结果表明[2](图1),在大脑中,NRG1由锥体神经元以活性依赖的方式合成和释放,结合中间神经元上的ErbB4受体,激活下游一系列信号通路,调节γ-氨基丁酸(GABA)的释放处于合适范围。如果某个脑区中NRG1-ErbB4通路失调,将会破坏该脑区的E/I平衡,抑制长时程增强(LTP),使得突触可塑性受损,脑区内部和脑区间的同步性也会遭到破坏,进而导致脑区相关的行为出现异常。以上结果均说明大脑内的锥体神经元可以通过NRG1-ErbB4通路调节大脑的稳态平衡。
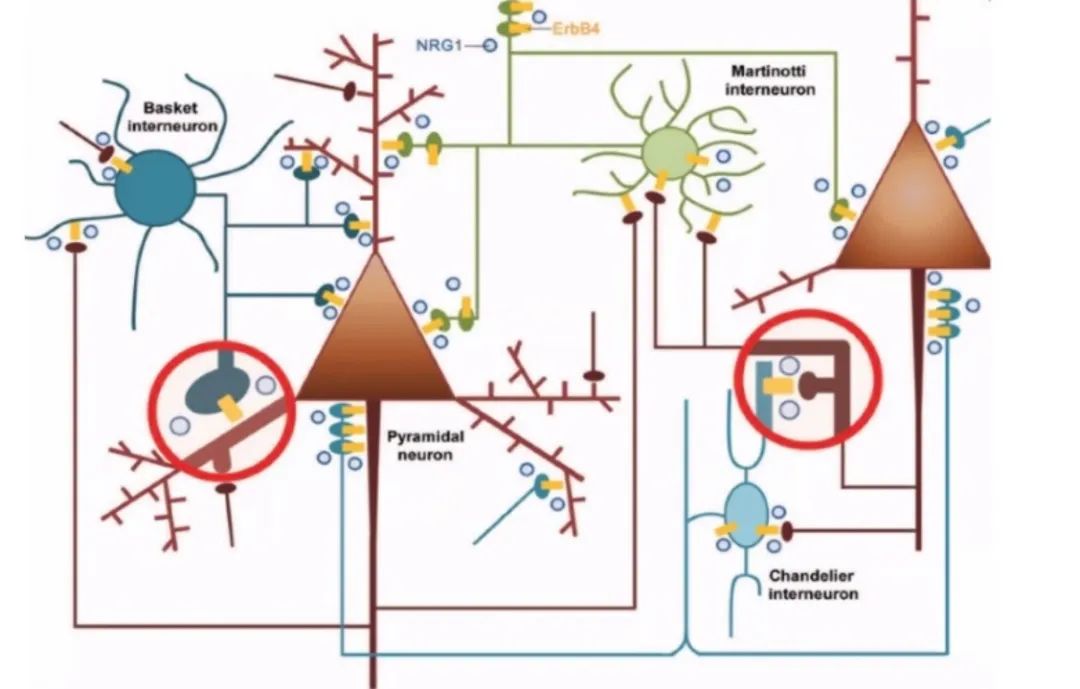
图1 NRG1/ErbB4 通过促进GABA能活性维持E/I平衡
二、 NRG1/ErbB4在突触可塑性和学习记忆编码中的作用
NRG1/ErbB4在维持大脑稳态中起重要作用,然而该通路是否参与调节学习记忆编码等功能相关行为尚不清楚。为此,梅林实验室开始探索NRG1/ErbB4对尖波涟漪(Sharp wave-ripples, SW-Rs)的影响。SW-Rs是一种海马神经元同步电活动的快速爆发,被很多研究证实与记忆巩固相关。研究表明,位置细胞(Place cell)在特定场景中的放电序列会在后续的SW-Rs中进行倒序回放[3]。破坏海马CA1区的SW-Rs,可以使相关的学习表现下降[4];反之,增强SW-Rs,可以提高学习表现[5]。
为验证NRG1浓度对SW-Rs的影响,梅林团队首先通过脑片膜片钳技术在海马CA1区记录到SW-Rs。人为加入NRG1分子后,SW-Rs出现的频率显著降低,但是单个SW-R的基本特性没有发生改变(图2),说明过多的NRG1会抑制SW-Rs的形成。
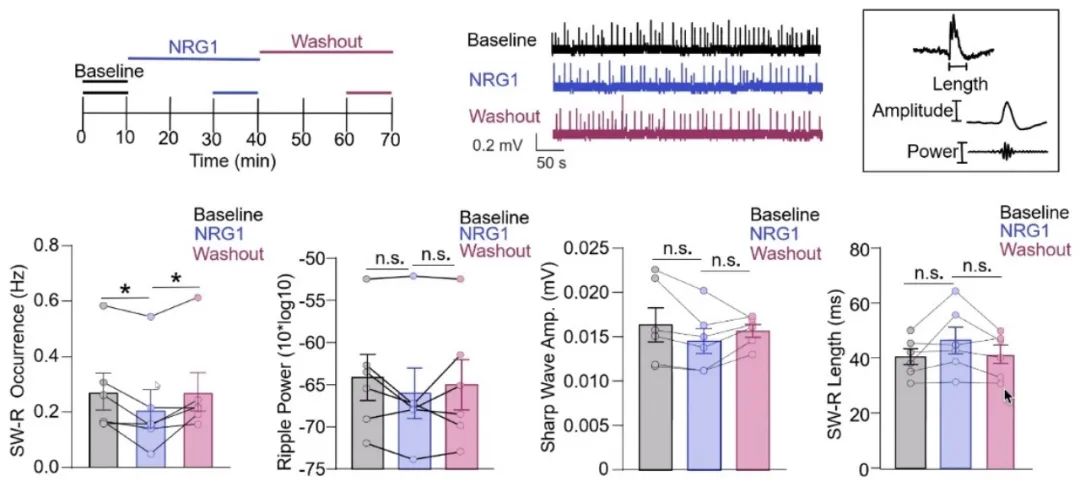
图2 加入NRG1后SW-Rs的出现次数减少
为证明ErbB4同样参与该过程,梅林实验室建立了ErbB4受体功能缺失小鼠(T796G),通过将ErbB4受体ATP结合位点中第796位的苏氨酸突变为甘氨酸,使ErbB4受体可以被外源性抑制剂1NM-PP1阻断[6]。研究发现,T796G鼠腹腔注射1NM-PP1后,海马神经元的微小抑制性突触后电流(mIPSC)频率显著降低,说明阻断ErbB4受体抑制了海马中的GABA能传递。同时,体内外的实验结果均表明,利用1NM-PP1抑制ErbB4受体活性后,在海马CA1区SW-Rs出现的频率显著增加(图3),并且该过程是可逆的。基于此,为进一步探究ErbB4活性降低是否可以影响小鼠的学习记忆编码,梅林团队利用“M迷宫”检测小鼠空间学习记忆能力,发现阻断ErbB4受体可以使小鼠的空间工作记忆受损(图4)。
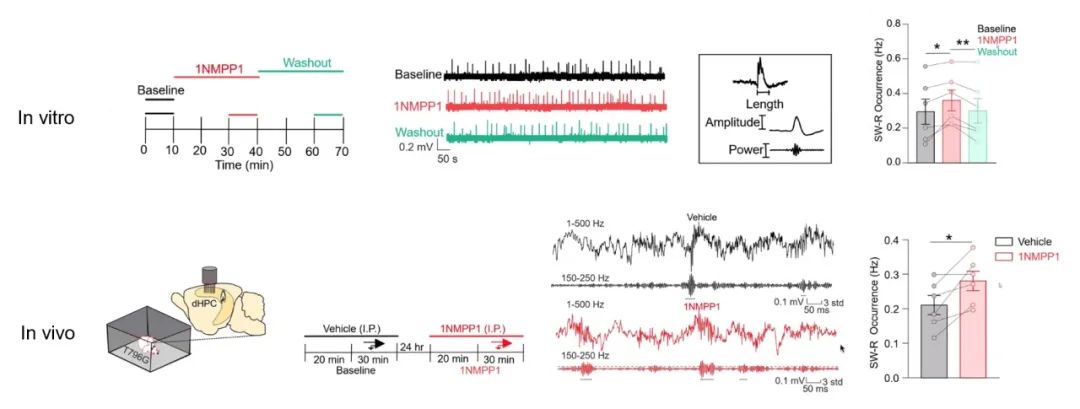
图3 体内外抑制ErbB4受体后SW-Rs的发生频率增加
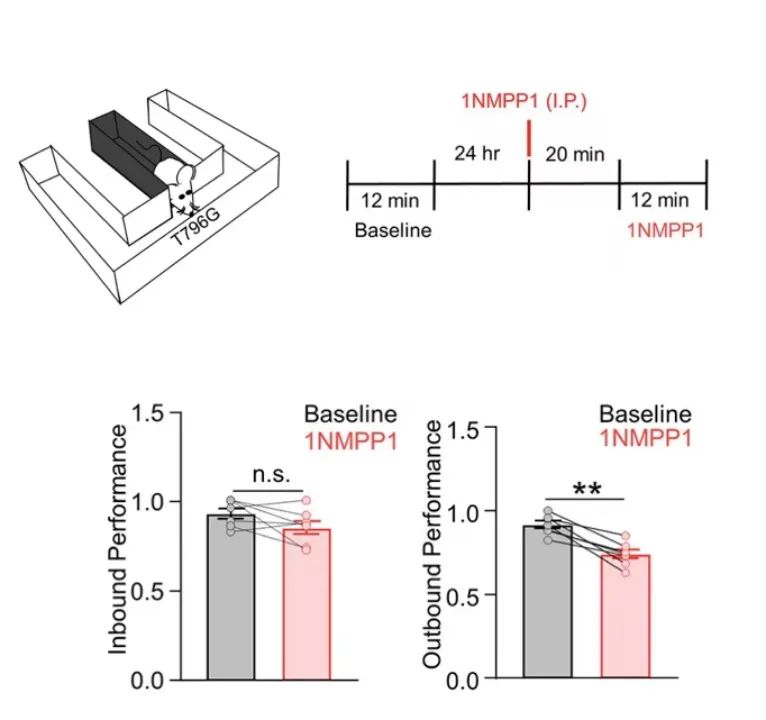
图4 阻断ErbB4受体破坏了小鼠的空间工作记忆
综上所述,在大脑中,NRG1-ErbB4通路是一个内源性调节系统,锥体神经元可利用该系统调控GABA的释放,维持E/I平衡和大脑稳态。正常情况下,在海马中NRG1和ErbB4活性须处于一定水平,使SW-Rs出现的频率处于相对合适的范围;该通路活性的异常可以导致SW-Rs的出现频率异常,进而引起相应的学习记忆受损。
三、ErbB4受体在热痛觉中的作用
热痛觉在脊髓中如何进行传导尚不明确,为解决该问题,梅林团队在小鼠脊髓背角(Spinal cord dorsal horn)中利用cFos基因标记了被热痛激活的神经元群体,发现这些cFos+神经元主要分布在I /II层,其中28%为ErbB4+神经元,数量多于CCK+和SST+神经元(图5)。与大脑皮层或海马不同,脊髓背角中的ErbB4+神经元多表达Vglut2,提示他们是兴奋性ErbB4+神经元。
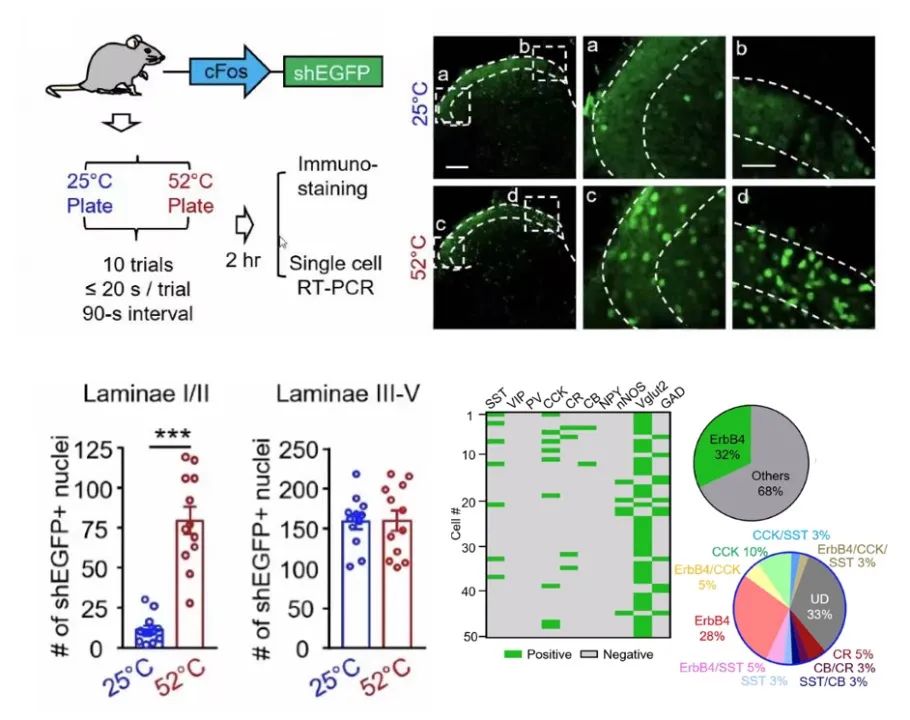
图5 脊髓背角中热痛激活的ErbB4+、SST+和CCK+神经元
此外,利用白喉毒素A(dtA)特异性杀伤脊髓背角中的ErbB+神经元会导致热痛觉传导受损(图6),说明脊髓背角I /II层中的ErbB4+神经元在热痛觉传导中具有重要作用。另有未发表的数据显示,脊髓中的ErbB4+神经元主要接收背根神经节(DRG)中TRPV1+神经元的投射,可以进一步与下游的中间神经元建立兴奋性突触联系(图7),这一环路对于介导热痛觉具有重要意义。
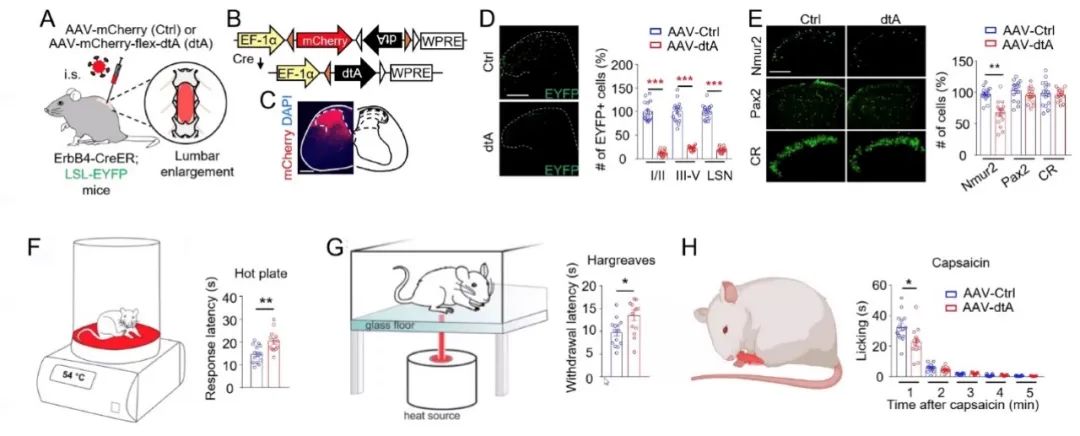
图6 损毁脊髓背角ErbB4+神经元导致热痛感觉受损
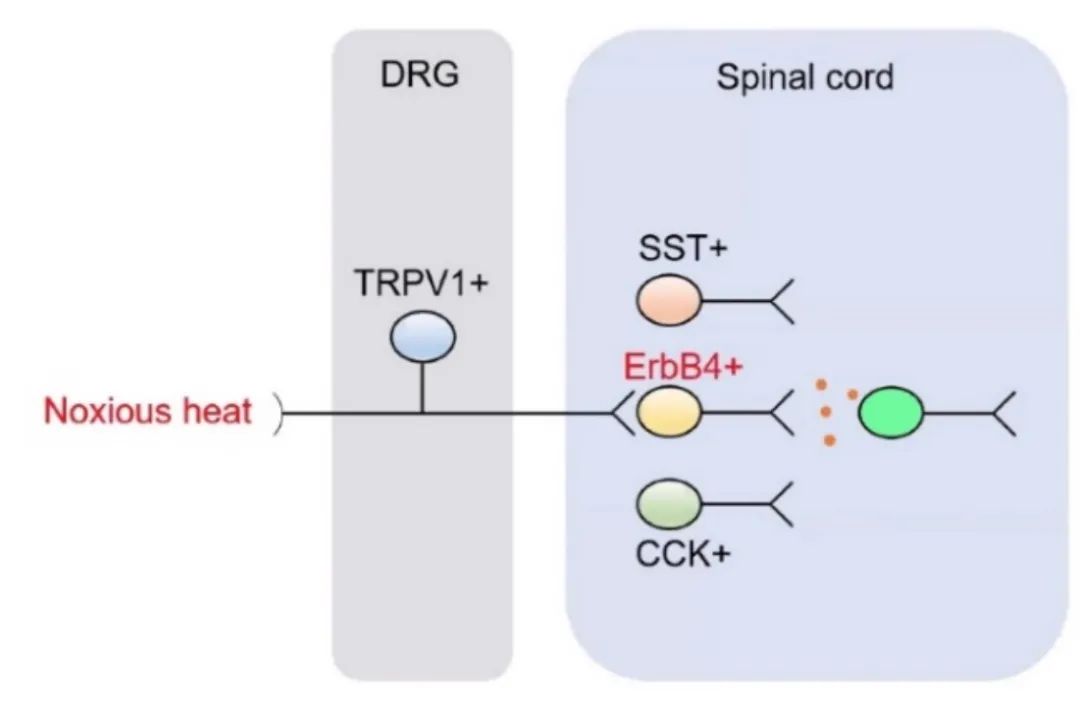
图7 热痛传导示意图
综上所述,梅林教授在本次报告中通过对本实验室既往研究结果的回顾,阐明了NRG1-ErbB4通路在维持大脑稳态中的重要作用。近期研究成果说明了该通路对突触可塑性和学习记忆编码的影响。报告最后展示了脊髓背角中ErbB4阳性神经元介导的神经环路在热痛觉感知和传导中的重要作用,进一步丰富了热痛觉的传导机制。
撰稿:李君昭;审核:张勇
参考文献
[1] Mei L, Xiong WC. Neuregulin 1 in neural development, synaptic plasticity and schizophrenia. Nat Rev Neurosci. 2008;9(6):437-452. doi:10.1038/nrn2392
[2] Mei L, Nave KA. Neuregulin-ERBB signaling in the nervous system and neuropsychiatric diseases. Neuron. 2014;83(1):27-49. doi:10.1016/j.neuron.2014.06.007
[3] Diba K, Buzsáki G. Forward and reverse hippocampal place-cell sequences during ripples. Nat Neurosci. 2007;10(10):1241-1242. doi:10.1038/nn1961
[4] Girardeau G, Benchenane K, Wiener SI, Buzsáki G, Zugaro MB. Selective suppression of hippocampal ripples impairs spatial memory. Nat Neurosci. 2009;12(10):1222-1223. doi:10.1038/nn.2384
[5] Oliva A, Fernández-Ruiz A, Leroy F, Siegelbaum SA. Hippocampal CA2 sharp-wave ripples reactivate and promote social memory. Nature. 2020;587(7833):264-269. doi:10.1038/s41586-020-2758-y
[6] Robinson HL, Tan Z, Santiago-Marrero I, et al. Neuregulin 1 and ErbB4 Kinase Actively Regulate Sharp Wave Ripples in the Hippocampus. J Neurosci. 2022;42(3):390-404. doi:10.1523/JNEUROSCI.1022-21.2021