熊志奇:神经疾病机理——基础与临床合作
4月25日,北京大学IDG麦戈文脑科学研究所邀请中科院上海脑智卓越中心熊志奇研究员,在金光楼邓祐才报告厅作了题为“神经疾病机理——基础与临床合作” 的精彩的学术报告。于翔教授主持报告会。本期学术笔记由该报告整理而成。
脑疾病的研究和临床诊治面临许多挑战:临床上多重神经系统疾病的表型重叠,而同一疾病的症状高度异质,给临床诊断及药物治疗增加了很多不确定性。如何通过实验动物模型精准地重现神经疾病的核心症状是研究神经系统疾病发生机制及筛选治疗靶点的关键。熊志奇研究员聚焦疾病关联基因,通过构建基因突变导致的神经系统疾病实验动物模型,并进行深入机制研究,揭示影响神经系统疾病发生发展的分子、细胞和神经环路机制。
1. Prrt2 基因缺失导致PKD 运动障碍的机理
PKD(Paroxysmal kinesigenic dyskinesia)是一种反复发作、运动诱发、持续时间短暂的运动障碍病,疾病的临床表现为舞蹈症、手足徐动症及肌张力障碍等运动失调状态,疾病多发于青少年时期。熊志奇研究员与临床专家吴志英、王柠、陈万金团队合作鉴定出PKD疾病中的首个致病基因Prrt2。PRRT2蛋白特异性的表达在神经元中,并且在小脑的颗粒细胞中有明显的表达富集。PRRT2蛋白与突触蛋白Syntaxin1A及SNAP25相互作用,抑制神经元突触内SNARE蛋白复合体的形成,从而调控囊泡入坞到突触前膜的过程。PRRT2 蛋白缺失上调了小脑中 PF-PC 突触短时程易化[1](图1)。
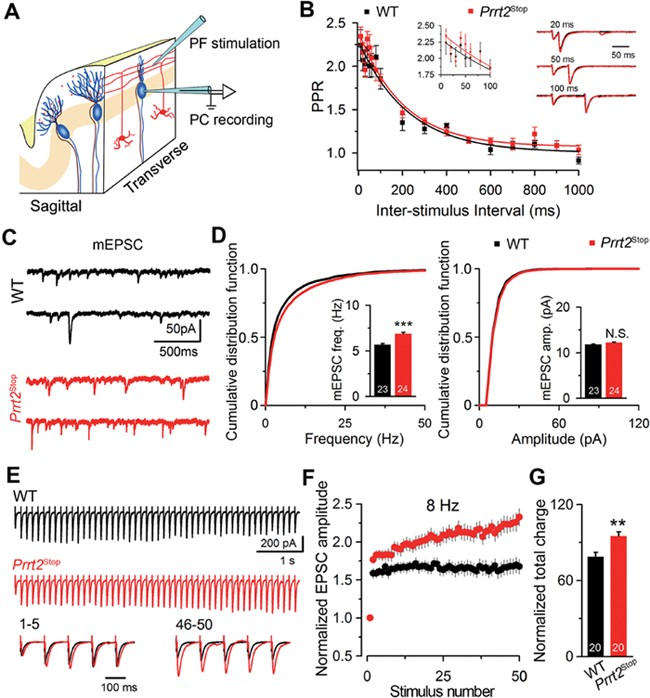
图 1 Prrt2stop小鼠中 PRRT2 蛋白缺失上调了小脑中PF-PC突触短时程易化[1]。
刺激Prrt2敲除小鼠的小脑能够诱导出与临床PKD病人相似的运动障碍表型[1](图2)。后续研究发现Prrt2基因的缺失会促进小脑神经元电活动的扩布性去极化(spreading depolarization)[2]。
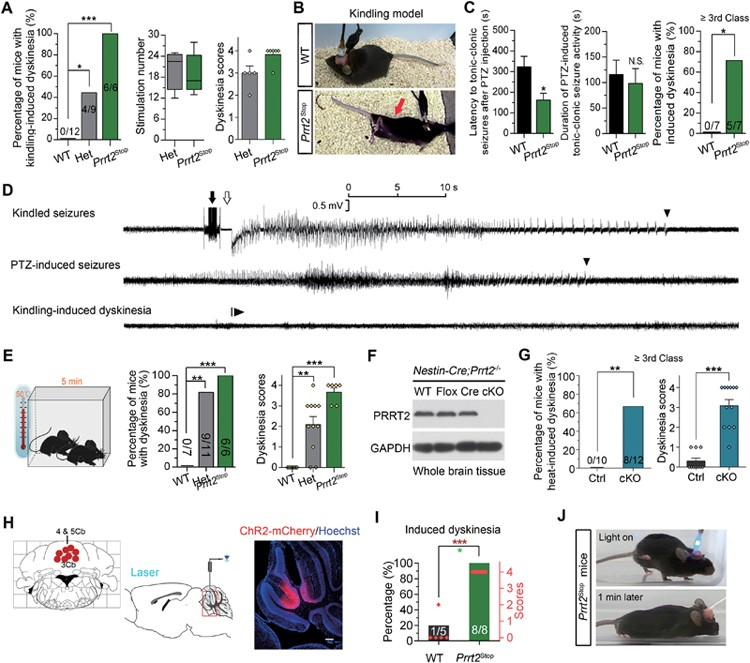
图2 Prrt2缺失导致运动障碍[1]。
(A-B)Prrt2stop小鼠在点燃诱发癫痫发作后表现出严重的阵发性运动障碍。(C-D)Prrt2stop小鼠在戊四氮(PTZ)诱发癫痫发作后表现出严重的阵发性运动障碍。(E)Prrt2stop在 50 摄氏度环境中热诱导阵发性运动障碍。(F-G)中枢神经系统中条件性敲除Prrt2小鼠热诱导阵发性运动障碍发作。(H-J)利用光遗传学在Prrt2stop小鼠小脑中局部激活神经元兴奋可诱导非自愿运动障碍。
PRRT2通过延缓失活状态钠离子通道的恢复降低神经元的持续兴奋能力,以此阻止局部刺激诱导小脑皮层中去极化扩布的发生和传播。相反,敲除Prrt2基因则可以使小脑皮层处于去极化扩布敏感状态。在这种状态下,局部刺激小脑皮层即可有效诱发去极化扩布。局部产生的去极化波几乎能够传遍整个小脑皮层,并通过浦肯野到小脑深部核团的神经连接干扰该环路中神经元的正常发放,最终导致运动障碍的发生[2](图3)。针对神经系统罕见病的致病机制的研究为临床的疾病症状干预与治疗提供了有力支持。
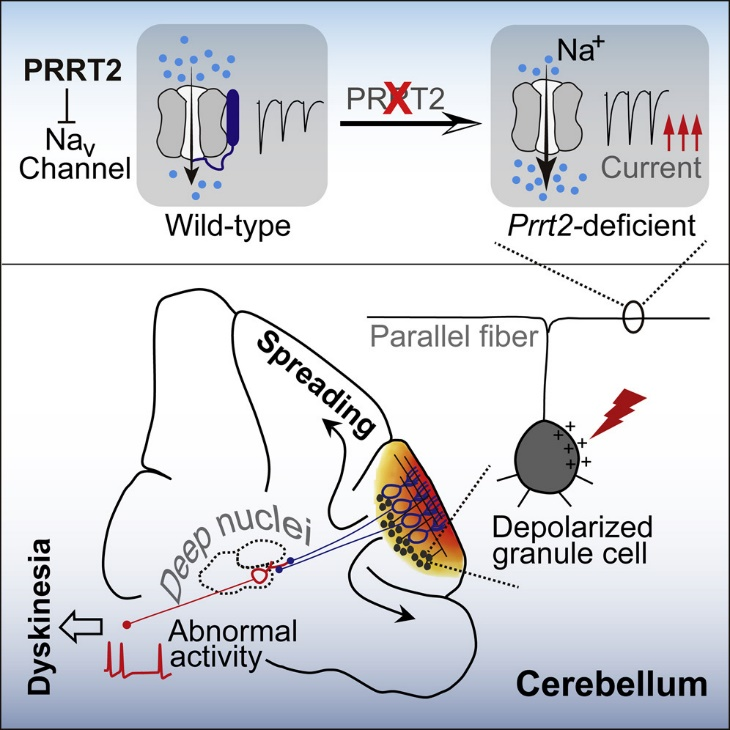
图3 PRRT2缺失或功能缺陷可以通过增强钠离子通道功能使小脑皮层对去极化扩布易感。去极化扩布在小脑皮层的传播干扰小脑浦肯野-深部核团环路功能并最终导致发作性运动障碍[2]。
2. 家族性脑钙化症的发病机制
家族性脑钙化病(Familial Brain Calcification,FBC)是以中枢神经系统内病理性钙化灶沉积为特征的神经遗传病,临床症状包括进行性运动、精神、认知障碍和头痛等。熊志奇研究员实验室与临床专家陈万金/王柠团队、焉传祝/赵翠萍团队共同发现了MYORG与CMPK2等基因在衰老过程中对脑内无机磷酸根累积导致的磷酸钙沉积的作用及星形胶质细胞在该过程中的保护作用[3,4]。
3. 神经疾病食蟹猴模型
熊志奇研究员还致力于构建灵长类的神经疾病模式动物。目前已经成功构建了具有与临床相近行为表型的天使综合征(母源UBE3A特异性敲除)、脆性X综合征(Fragile X Syndrome)和强迫症样行为的食蟹猴模型,为相关神经疾病的高级认知水平研究提供了宝贵发的灵长类动物模型,也为后续疾病的症状诊断、发病机理和治疗方案的研究提供了帮助。
撰稿:秦琪,审核:于翔
参考文献
[1] Tan G H, Liu Y Y, Wang L, et al. PRRT2 deficiency induces paroxysmal kinesigenic dyskinesia by regulating synaptic transmission in cerebellum[J]. Cell Res, 2018, 28(1): 90-110.
[2] Lu B, Lou S S, Xu R S, et al. Cerebellar spreading depolarization mediates paroxysmal movement disorder[J]. Cell Rep, 2021, 36(12): 109743.
[3] Yao X P, Cheng X, Wang C, et al. Biallelic Mutations in MYORG Cause Autosomal Recessive Primary Familial Brain Calcification[J]. Neuron, 2018, 98(6): 1116-1123.e5.
[4] Zhao M, Su H Z, Zeng Y H, et al. Loss of function of CMPK2 causes mitochondria deficiency and brain calcification[J]. Cell Discov, 2022, 8(1): 128.