Xin Duan: Trans-Seq: Translating Transcriptomics to Connectomics at Retinotecal Synapses
8月22日,来自加州大学旧金山分校(UCSC) Weill神经科学研究所的段昕副教授围绕其实验开发的“Trans-Seq”技术作了精彩的报告。本期学术笔记根据他题为“Trans-Seq: Translating Transcriptomics to Connectomics at Retinotecal Synapses”的学术报告整理而成。
长期以来,神经科学中的投射研究需要对神经元的上、下游进行标记、操纵,人们已开发出多种工具可用于顺向、逆向跨突触标记。但目前存在的工具都面临着效率与损伤之间的权衡:对细胞损伤小的标记物往往跨突触标记效率较低,需要较高精度手段才能在下游观察到,例如AAV 1;标记效率较高的标记手段可能会遇到特异性不够强(不只跨单突触标记、既顺向又逆向标记)、细胞毒性太大等问题,例如狂犬病病毒。尤其对于长距离的投射,胞体和轴突末梢之间的物质交换更加困难,标记物的高效率与低损伤更是难以兼顾。如果需要对长距离投射下游神经元进行单细胞测序,既要求顺向跨突触标记的效率较高(这样才可以从流式分选中区分),也要求标记后细胞状态良好(单细胞测序要求分选时获得活细胞),这样的要求是目前的顺向标记技术难以满足的。
段昕实验室对视网膜向上丘(superior colliculus)(SC)的投射非常感兴趣,希望研究接收视网膜投射的SC细胞群体的基因表达特性。这种投射距离很长(如图1.a),需要高效的顺向跨单突触标记,同时对细胞的损伤较小。此外,在Cre转基因鼠的帮助下,可以研究视网膜特定细胞类群向SC的投射,这就要求顺向标记物在视网膜具有细胞特异性,在SC只沿突触传递而不受细胞类型影响。
基于这样的需求,段昕实验室利用麦胚凝集素(wheat germ agglutinin) (WGA)的跨突触特性,将其与mCherry、mRuby等荧光蛋白从N端、C端融合,然后用AAV 2在视网膜递送这种融合蛋白的序列。AAV 2会偏好于感染视网膜的神经节细胞(RGC),从而减少视网膜其他细胞的影响,专注于RGC向SC的投射。对SC荧光信号的统计发现,WGA-mCherry(mWmC)可以高效地实现跨突触传递,并且传递后依然保有较强的荧光信号,比其他类型的融合蛋白强许多倍。对初级视皮层、外侧后丘脑核等二级突触投射的脑区,则没有明显荧光信号,这说明mWmC很可能只跨单突触标记。
为了验证mWmC在SC标记的细胞是单突触连接,研究者在视网膜共注射ChR2-YFP和mWmC的AAV 2,以SC的红色荧光细胞为目标,用光刺激激活视网膜RGC的轴突末梢,同时用膜片钳记录SC的mWmC阴性、阳性细胞的兴奋性突触后电位,验证了mWmC的跨单突触标记。
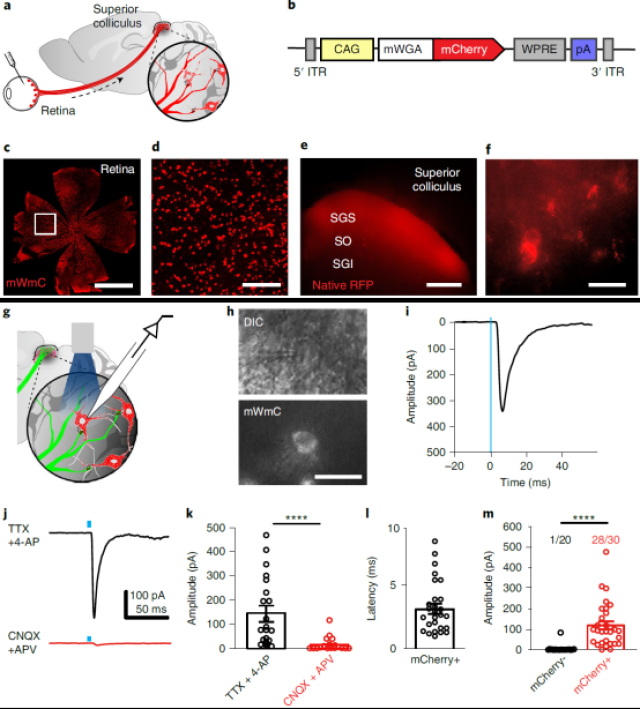
图1 mWmC从视网膜向SC跨突触传递
在前人的研究中,WGA会跨多突触传递,也会逆向传递,并且传递后很容易降解,而mWmC却跨单突触顺向传递,并且能够稳定发放荧光,这与WGA的性质不符,研究者试图验证mWmC这些新的性质是否属实。比较了WGA-555(WGA与Alexa-555荧光染料融合)、ctt-WGA(截去C端的WGA)、mWmC在视网膜向SC的顺向标记后,研究者发现mWmC与溶酶体有较强的共定位(图2),很可能是mCherry的抗降解能力较强,所以可以在溶酶体中富集并保持稳定,而在溶酶体中的富集也阻止了mWmC继续向下一突触传递。在视网膜特定细胞类型的实验中,研究者发现AAV2表达的mWmC并不发生逆向跨突触事件。综合来说,研究者证实了mWmC的顺向单突触传递特性。
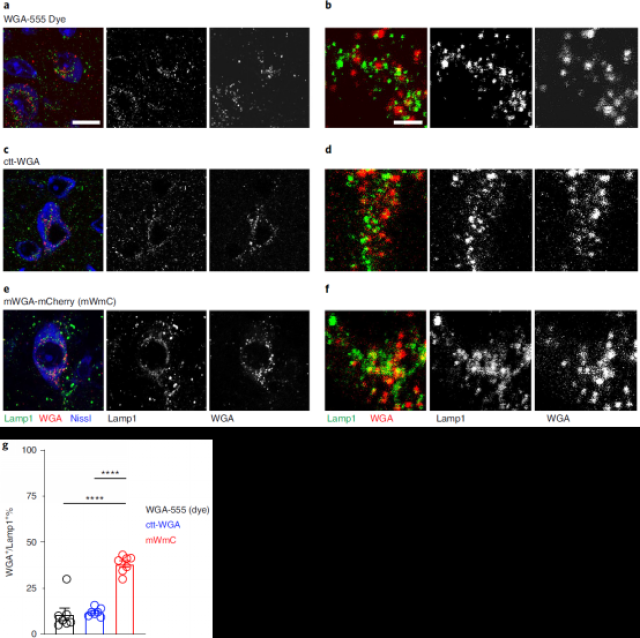
图2 mWmC跨突触后在溶酶体富集
验证了mWmC特性之后,研究者利用它来实现最初的目标—研究SC接收视网膜投射的细胞类群的基因表达特性。在视网膜注射AAV2-mWmC,解剖SC脑区并流式分选mCherry阳性、阴性细胞进行单细胞测序(如图3)。对测序结果的分析,发现了3类兴奋性细胞和5类抑制性细胞。为每类细胞找到了Marker基因,特别是其中一类兴奋性细胞(ESC1)找到了有趣的Marker基因—肾连蛋白(nephronectin)基因Npnt。
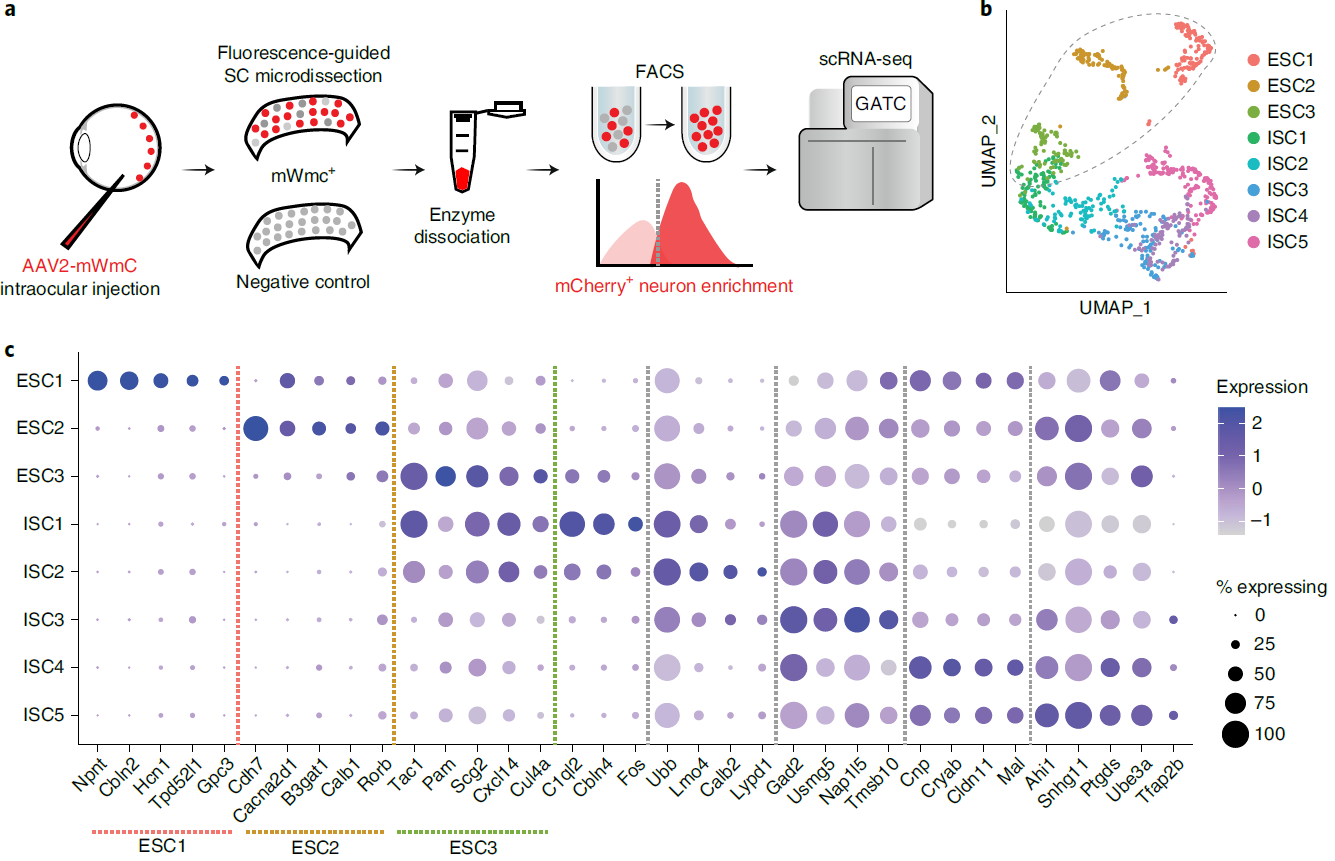
图3 对顺向标记的神经元进行单细胞转录组测序
接着,研究者利用Cre-dependent AAV载体在转基因鼠的特定细胞类群中表达mWmC,标记特定细胞在SC的下游细胞。用Kcng4-Cre小鼠标记αRGC的下游细胞;用Cart-Cre标记ooDSGC下游;用Pan-Cre标记所有RGC下游。并对这几种细胞的下游细胞进行测序(图4)。发现αRGC主要与Npnt阳性的ESC1类群连接,而ooDSGC不与ESC1类群连接;ESC2类群更多地与αRGC连接;ESC3类群更多地与ooDSGC连接。由此大致总结出RGC向SC的投射规律(如图5)。
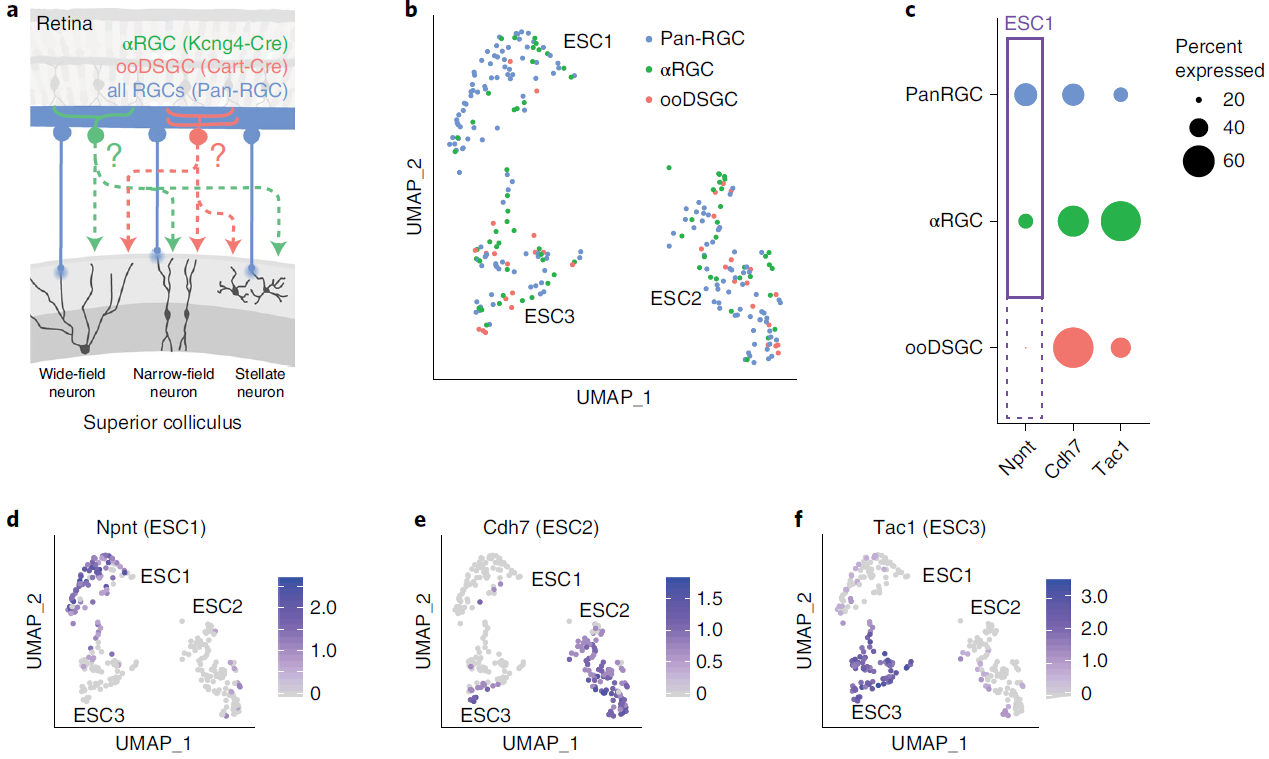
图4 对不同类型RGC的下游细胞进行测序
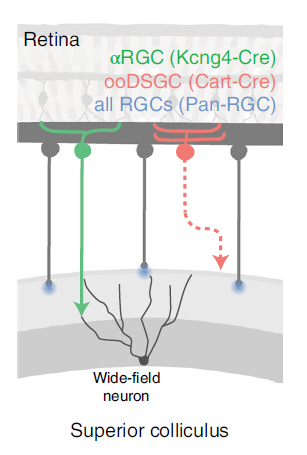
图5 RGC向SC的投射模式示意图
除了上述精彩的工作外,段昕副教授也介绍了“Trans-seq”技术与“MERFISH”技术结合的未发表工作,展现出这一技术强大能力。
参考文献
Tsai, N. Y., Wang, F., Toma, K., Yin, C., Takatoh, J., Pai, E. L., Wu, K., Matcham, A. C., Yin, L., Dang, E. J., Marciano, D. K., Rubenstein, J. L., Wang, F., Ullian, E. M., & Duan, X. (2022). Trans-Seq maps a selective mammalian retinotectal synapse instructed by Nephronectin. Nature neuroscience, 25(5), 659–674.
https://doi.org/10.1038/s41593-022-01068-8