Nashat Abumaria: 面对不可控的失败,我们的大脑如何应对?
撰文:魏昌盛,审核:于翔
2025年3月25日,受北京大学IDG麦戈文脑科学研究所邀请,复旦大学脑科学研究院Nashat Abumaria(那德)研究员在金光楼101报告厅作了题为“A neural circuit regulates behavioral switch in response to prolonged uncontrollability”的学术报告,于翔教授主持报告会。
Abumaria研究员曾先后在德国灵长类动物中心Eberhard Fuchs教授和清华大学刘国松教授实验室进行博士后训练,分别从事抑郁症和突触可塑性相关研究。他的实验室长期关注于情绪和认知,对厌恶记忆、正常记忆、适应性决策和相关认知障碍背后的神经机制。此次报告中,Abumaria研究员建立了两种长期挫败动物模型,通过环路示踪、光纤成像、微型双光子等技术向我们展示了在长期不可控的挫败环境下,动物从行动(the action style)到不行动(the no action style)这种行为模式转变背后的机制以及相关神经环路。
在面对充满挑战的环境时,我们往往需要在“持续努力”与“适时放弃”之间做动态平衡的抉择,以此在节约精力和资源的同时获得最大效益。早在1981年,著名的德国认知心理学家Julius Kuhl就提出了“行动控制理论(Action Control Theory)”:当个体遭遇不可控情境下,会默认主动发起目标导向行为(如"我能解决这个问题"的积极信念),即行动阶段(the action style),但当不可控状态持续超过临界值,个体会表现出放弃尝试,即非行动阶段(the no action style)(1)。然而,这种适应性决策背后的确切机制以及神经环路基础仍不清楚。
为了研究这一问题,Abumaria研究员首先建立了两个长期挫败的小鼠实验范式:通过连续3天给予小鼠最小强度的足底电击,可以观察到小鼠由第一天的行动阶段,表现为奔跑、跳跃、转圈,到第三天非行动阶段的渐进式行为过渡,并且这种变化并不是疼痛脱敏、肌肉疲劳或者抑郁造成的;类似的,通过机械化装置,连续多次(每日60次试验,持续3天)将小鼠置于水中,可以观察到与电击模型高度类似的行为转变。
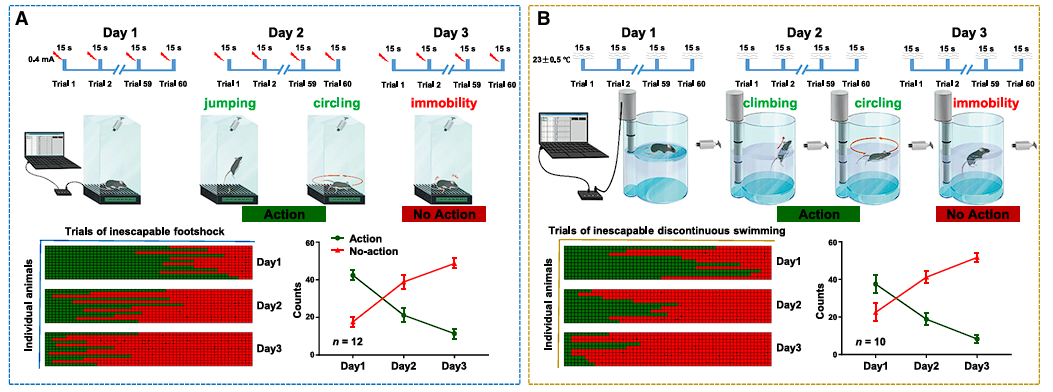
图1. 两种长期挫败的小鼠实验范式。A电击范式;B水环境应激范式。(2)
有了明确的行为范式后,Abumaria研究员进一步对这种行为转变背后的神经化学和神经解剖学基础进行了研究。通过钙成像与光纤记录等手段,他发现两种行为范式下小鼠行为模式的转变均与眶额叶皮层(OFC)GABA能神经元活动密切相关。钙成像显示,GABA能神经元的激活数量及强度随行为模式的转变同步下降(r = 0.85),而谷氨酸能神经元未显示出类似的现象。在神经环路层面上,Abumaria研究员发现蓝斑(LC)去甲肾上腺素(NE)能神经元特异性投射至OFC的GABA能神经元,通过α1A肾上腺素受体介导双向调控——激活甲肾上腺素信号促进行动阶段,抑制则促进非行动阶段。微透析实验证实OFC内甲肾上腺素浓度随行为转变逐渐耗竭,且这一过程依赖于环境不可控的程度:当任务调整为"主动终止刺激"的可控范式时,甲肾上腺素耗竭与GABA活动下降现象完全消失。
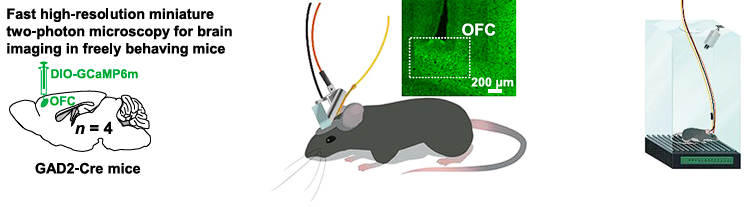
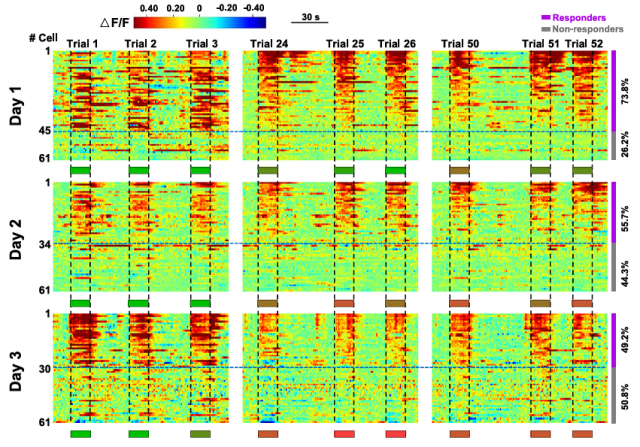
图2. 行为转变与眶额叶皮层中抑制性神经元活动的减少有关。(2)
综上,通过建立两种长期挫败的小鼠实验范式,利用钙成像、光纤记录、微透析等多种技术手段,Abumaria研究员证明了投射到眶额叶皮层内GABA能神经元的去甲肾上腺素能神经元是应对长期的不可控环境而转换行为的适应性决策的关键调节器。在眶额叶皮层中减少去甲肾上腺素和下调α1受体,会导致驱动行动所需的抑制性神经元的数量和活动的减少,从而使行动阶段转变为非行动阶段。这些发现对更好的理解适应性决策的机制和消极情绪的研究具有重要意义。
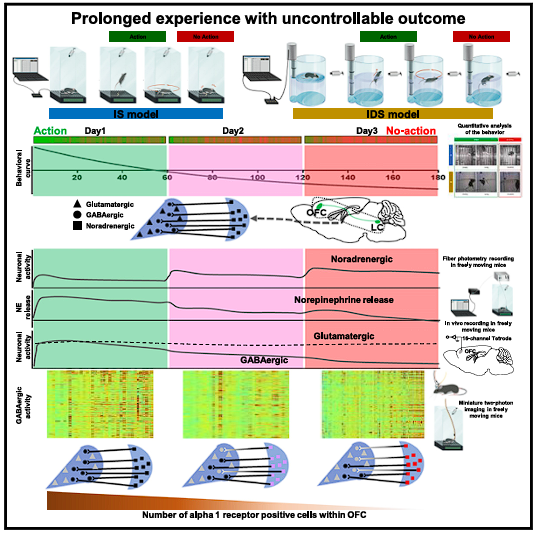
图3. 长期的不可控环境造成了由“持续努力”到“适时放弃”的行为转变,眶额叶皮层内GABA能神经元是这一行为转变的主要调控者。(2)
参考文献
1. Kuhl, J. (1981). Motivational and functional helplessness: the moderating effect of action vs. state orientation. J. Pers. Soc. Psychol. 40, 155–170.
2. Li C, Sun T, Zhang Y, Gao Y, Sun Z, Li W, Cheng H, Gu Y, Abumaria N. A neural circuit for regulating a behavioral switch in response to prolonged uncontrollability in mice. Neuron. 2023 Sep 6;111(17):2727-2741.e7.
doi: 10.1016/j.neuron.2023.05.023. Epub 2023 Jun 22. PMID: 37352858.