钙信号在细胞生命活动中发挥着重要的作用。胞内Ca2+水平即使是轻微的改变,也可被一类称为钙感受蛋白(Ca2+-sensor protein)的分子精确地捕捉到,继而引发特定的生理学效应。
KChIP3/DREAM/Calsenilin(以下简称KChIP3)是一种在神经系统高表达的钙感受蛋白,隶属NCS(neuronal calcium sensor)家族。但与一般的钙感受蛋白不同,KChIP3表现出显著的多功能特性,如位于胞核,可与DRE元件(downstream regulatory element)结合,调节基因转录;位于胞浆,可与presenilin等胞浆蛋白作用;位于胞膜,可与Kv4等通道作用,对它的多重命名也体现了其多功能特性。
既往研究集中在KChIP3在中枢神经元的功能,而近些年来的多项研究显示KChIP3在外周感觉神经元——背根神经节(dorsal root ganglion,DRG)中也有较高的表达,提示其可能参与外周感觉信息加工,但其详细功能尚不知晓。在本研究中,该课题组对外周KChIP3在痛觉中的功能进行了探讨。结果表明,KChIP3与伤害性热感受的关键分子——Ca2+通透的TRPV1(transient receptor potential vanilloid 1)在DRG有共定位,并且KChIP3氨基端31-50位氨基酸与TRPV1胞内N端和C端均有直接的结合,其结果可导致TRPV1膜表达的下降和TRPV1介导Ca2+内流的减少。TAT序列引导的可穿膜肽TAT-31-50也表现出显著地抑制TRPV1通道Ca2+内流的效应,并且经鞘内注射给药后,可减轻完全弗氏佐剂(complete Freund‘s adjuvant,CFA)诱导炎症痛模型大鼠的热痛敏行为,改善其异常步态。为进一步确认TAT-31-50在外周的作用,经脚掌内注射TAT-31-50,发现其可以显著减缓辣椒素足底注射诱导的大鼠自发痛和热痛敏行为。由于在课题组通过CRISP/CAS9构建的kcnip3-/-大鼠中,仍然可以检测到TAT-31-50的镇痛效应,因此TAT-31-50抑制TRPV1受体功能的效应并不依赖于内源性KChIP3。总之,该研究揭示了KChIP3一种新的作用蛋白——TRPV1,证明KChIP3的外周镇痛作用依赖于其对TRPV1功能的抑制,同时,构建的一种具有镇痛作用的穿膜肽TAT-31-50,具有潜在的临床应用价值。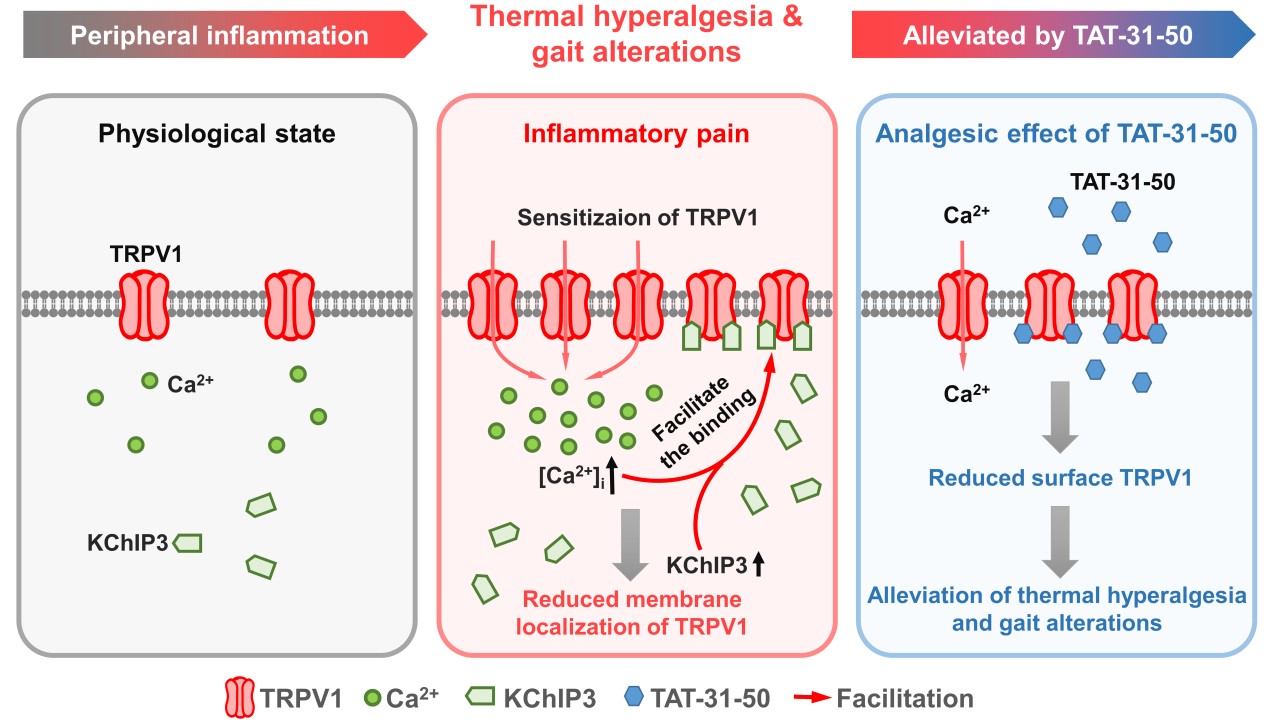
这是张瑛副教授、王韵教授课题组在2010年首次报道KChIP3对NMDA受体的功能调控作用(Zhang Y et al. J Neurosci. 2010 Jun 2;30(22):7575-86)之外,再次阐明KChIP3蛋白的一种新功能——TRPV1作用蛋白。文章发表在美国神经科学会会刊The Journal of Neuroscience(2018 Feb 14;38(7):1756-1773)。2009级基础医学八年制博士生田纳西和2010级基础医学八年制博士生徐煜为该文的共同第一作者。张瑛副教授、王韵教授为共同通讯作者。