李毓龙课题组在《Neuron》在线发表文章
报道新型基因编码的去甲肾上腺素荧光探针
2019年3月25日,学术期刊《Neuron》在线发表北京大学麦戈文脑科学研究所、北京大学生命科学学院、北大-清华生命科学联合中心、北京脑科学研究所李毓龙研究组题为“A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine”的研究论文。该研究中,李毓龙研究组首次成功开发了新型、可基因编码的去甲肾上腺素荧光探针,并将其成功应用于斑马鱼和小鼠中检测内源去甲肾上腺素的动态变化。该探针可特异性地区分结构相似的去甲肾上腺素与多巴胺,将成为研究去甲肾上腺素相关神经环路的重要工具。
李毓龙课题组一直以来致力于系统性地发展前沿神经生物学探针技术用于研究复杂神经细胞之间的多种通讯连接,2018年已经率先在世界上发展了乙酰胆碱(Jing et al., Nature Biotechnology, 2018)及多巴胺探针(Sun et al., Cell, 2018),2019年又报道了用于定位电突触的荧光探针(Wu et al., eLife, 2019),这次报道的去甲肾上腺素探针,是这一系统性工作的又一重要环节,为今后开发其他神经递质、神经调质探针奠定了扎实的研究基础。
去甲肾上腺素(Norepinephrine, NE)作为一种重要的单胺类神经递质,在中枢神经系统和交感神经系统中都参与诸多必要的生理过程,如感觉信号的调节、注意力的调控、清醒与睡眠、学习与记忆等。去甲肾上腺素释放或信号传递的受损与一系列的精神疾病和神经退行性病变息息相关。因此,在复杂神经环路中以高时空分辨率的方式检测去甲肾上腺素的动态分布对完整解析去甲肾上腺素在生理及病理条件下的功能和调节尤为重要。然而受限于现有技术的灵敏度、特异性、时空分辨率和组织创伤性等,无法实现对它在体分布的精确检测。
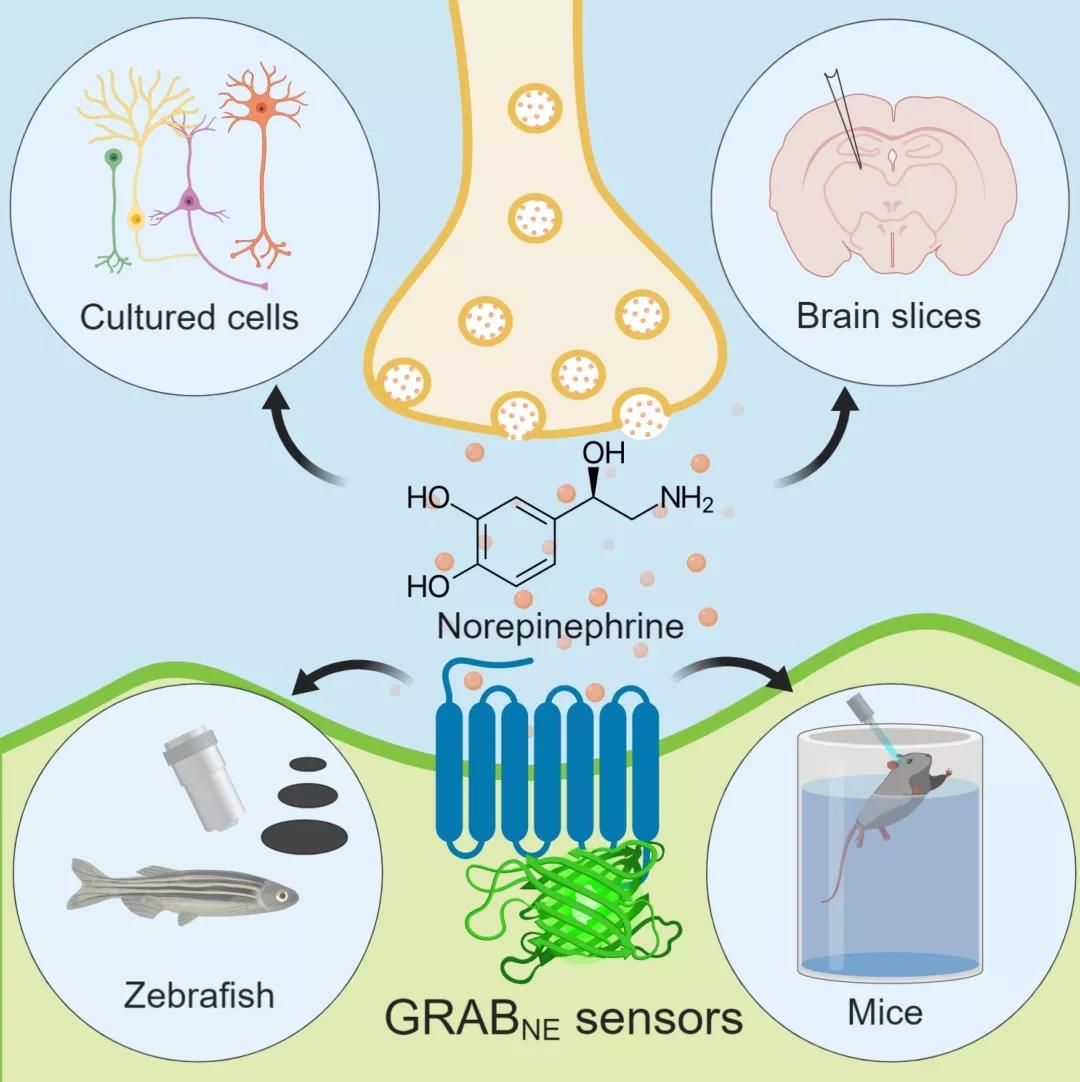
为了解决以上的技术瓶颈,李毓龙研究组开发并优化了一类基于G蛋白偶联受体激活(GPCR Activation Based)的去甲肾上腺素荧光探针(GRABNE)。通过在人源去甲肾上腺素受体特定位置嵌入对结构变化敏感的荧光蛋白(cpEGFP),使去甲肾上腺素这一化学信号转化为荧光信号,结合现有的成像技术,即可实时监测去甲肾上腺素浓度的动态变化情况。通过对探针全方位的优化,开发出具有低/高亲和力的两种版本的荧光探针(分别命名为NE1m和NE1h),除均具有极高的分子特异性和时空分辨率外,还可分别用于检测局部突触传递(synaptic transmission)和非局部非突触传递(volume transmission)的去甲肾上腺素释放。
基于G蛋白偶联受体的去甲肾上腺素探针
利用该可遗传编码探针,李毓龙研究组通过转染、病毒注射以及构建转基因动物等手段,可将探针表达在细胞、小鼠脑片、斑马鱼和小鼠中。通过构建转基因斑马鱼系在斑马鱼大脑神经系统中广泛表达GRABNE1m探针可成功检测清醒斑马鱼中脑由视觉刺激引发的与时间锁定的特异性NE释放,通过稀疏标记去甲肾上腺素探针还可记录到单细胞分辨率下重复视觉刺激引发的NE释放信号。通过病毒介导的表达,使用激光脉冲对LC-NE神经元的光遗传学激活可靠地引起自由移动小鼠LC的光纤记录信号中GRABNE1m荧光的增加。在小鼠强迫游泳测试和尾部悬吊测试(两者均为经典的应激性行为)期间,观察到由应激行为触发的GRABNE1m荧光显著增加,揭示该行为与NE动态变化的关系。
为了解决以上的技术瓶颈,李毓龙研究组开发并优化了一类基于G蛋白偶联受体激活(GPCR Activation Based)的去甲肾上腺素荧光探针(GRABNE)。通过在人源去甲肾上腺素受体特定位置嵌入对结构变化敏感的荧光蛋白(cpEGFP),使去甲肾上腺素这一化学信号转化为荧光信号,结合现有的成像技术,即可实时监测去甲肾上腺素浓度的动态变化情况。通过对探针全方位的优化,开发出具有低/高亲和力的两种版本的荧光探针(分别命名为NE1m和NE1h),除均具有极高的分子特异性和时空分辨率外,还可分别用于检测局部突触传递(synaptic transmission)和非局部非突触传递(volume transmission)的去甲肾上腺素释放。
北京大学麦戈文脑科学研究所、北京大学生命科学学院、北大-清华生命科学联合中心李毓龙研究员为本文的通讯作者。李毓龙研究组博士生冯杰思为第一作者;井淼、王欢、张雅君、董傲、武照伐、吴昊为此项研究成果做出了重要贡献。该工作的合作者有:中国科学院神经科学研究所的杜久林研究组;纽约大学的林大宇研究组;美国国立卫生研究院的崔国红研究组;弗吉尼亚大学医学院朱骏研究组;南加州大学的Andrew S. Hires研究组。本工作获得了北京大学生物膜与膜生物工程国家重点实验室、北大-清华生命科学联合中心、国家重点基础研究发展计划(973计划)、国家自然科学基金、美国脑计划对李毓龙研究组的大力支持。