李毓龙课题组合作在《Science》发表文章
揭示腺苷在睡眠稳态调控的神经环路机制
2020年9月4日,《Science》杂志发表了题为《Regulation of sleep homeostasis mediator adenosine by basal forebrain glutamatergic neurons》的研究论文,该研究由北京大学生命科学学院、北京大学麦戈文脑科学研究所、北大-清华生命科学联合中心李毓龙研究组与中国科学院脑科学与智能技术卓越创新中心(神经科学研究所)、上海脑科学与类脑研究中心、神经科学国家重点实验室徐敏研究组合作完成。该项研究利用新型遗传编码的腺苷探针,发现基底前脑区的谷氨酸能神经元对于睡眠压力的积累起着重要的调控作用,进一步揭示了睡眠稳态调控的神经环路机制,为探索睡眠障碍的治疗方法提供了重要参考。
睡眠是动物界普遍存在的现象,人类大约有三分之一的时间用于睡眠。然而睡眠是如何被调节的目前尚不清楚。经典的睡眠调控模型认为,睡眠的调节分为两个方面,昼夜节律和睡眠稳态。昼夜节律通过内在的生物钟控制一天中睡眠觉醒的时间;睡眠稳态主要由睡眠压力进行调控,控制机体获得一定的睡眠量。随着清醒时间的延长,睡眠压力逐渐增加;随着睡眠的进行,睡眠压力被逐渐清除。睡眠稳态调节系统会在睡眠受到干扰时发挥作用,例如:熬夜之后睡得更“香”并且时间更长。目前,主流理论认为“腺苷”参与到睡眠稳态调节过程中,其在清醒状态下的积累导致了“困意”的产生,而咖啡的主要成分咖啡因可以通过阻断腺苷与其受体的结合而达到促进清醒的效果。基底前脑被认为是腺苷参与睡眠稳态调控的重要脑区,环路层面的研究表明,该区域的局部神经环路参与到对睡眠觉醒的调控中,然而神经元活动调控腺苷释放的机制目前还不清楚。这限制了人们对睡眠觉醒调控机制的深入解析。
为了实现在睡眠觉醒周期中对基底前脑区胞外腺苷浓度高时空分辨率的检测,李毓龙研究组开发了一种新型的遗传编码的腺苷探针,该探针可以将胞外腺苷浓度的变化转化为探针荧光强度的快速变化。
利用该腺苷探针,徐敏研究组发现基底前脑区的腺苷浓度在清醒状态时较高,在非快速眼动睡眠时较低,这与之前采用微透析法测量腺苷浓度变化的研究结果相一致。然而,小鼠的快速眼动睡眠时长较短,传统的微透析方法无法对快速眼动睡眠时期的腺苷浓度进行精确测量。得益于该探针的高时间分辨率,徐敏研究组首次发现,腺苷在快速眼动睡眠时期也存在很高的浓度,并且高于清醒和非快速眼动睡眠状态。不仅如此,研究者观察到,腺苷浓度在睡眠时相转变时存在快速的变化,提示其与神经元的活动密切相关。
为了进一步探究腺苷浓度增加与神经元活动的关系,徐敏研究组探究了基底前脑区两类神经元:乙酰胆碱能神经元和谷氨酸能神经元与腺苷浓度变化的相关性和因果性。结果表明这两类神经元的钙活动与胞外腺苷浓度高度相关,并且神经活动总是提前于腺苷释放。光遗传激活这两类神经元能引起胞外腺苷浓度不同程度的增加,而谷氨酸能神经元的激活是腺苷浓度增加的主要原因。进一步,研究人员特异性损毁基底前脑区的谷氨酸能神经元,结果表明,胞外腺苷浓度的增加显著低于对照组小鼠。以上试验表明,谷氨酸能神经元的活动参与调控胞外腺苷积累过程。
前人的研究表明,基底前脑区腺苷积累受损会导致睡眠稳态调节异常,基于以上实验结果,徐敏研究组猜测,基底前脑区谷氨酸能神经元的缺失可能会影响睡眠稳态。结果表明:基底前脑区谷氨酸能神经元缺失的小鼠睡眠压力显著降低(清醒时长显著增加),并且睡眠稳态也发生了改变——睡眠剥夺后睡眠时长的增加显著低于对照组小鼠,并且睡眠压力的清除速率显著快于对照组小鼠。以上实验表明,基底前脑区的谷氨酸能神经元对睡眠压力的积累起到了重要调控作用。
该研究揭示了基底前脑区域的谷氨酸能神经元在介导清醒状态下睡眠压力的积累中所扮演的重要角色,为进一步研究睡眠稳态调节机制奠定了坚实的基础。
该项研究的合作者为北京大学李毓龙研究员、武照伐博士和上海交通大学医学院张思宇研究员,由博士研究生彭婉玲、宋鹍在中科院脑智卓越中心徐敏研究员的指导下完成,该项目得到了中科院、科技部、基金委、上海市科委、北京市科委、广东省科委的资助。
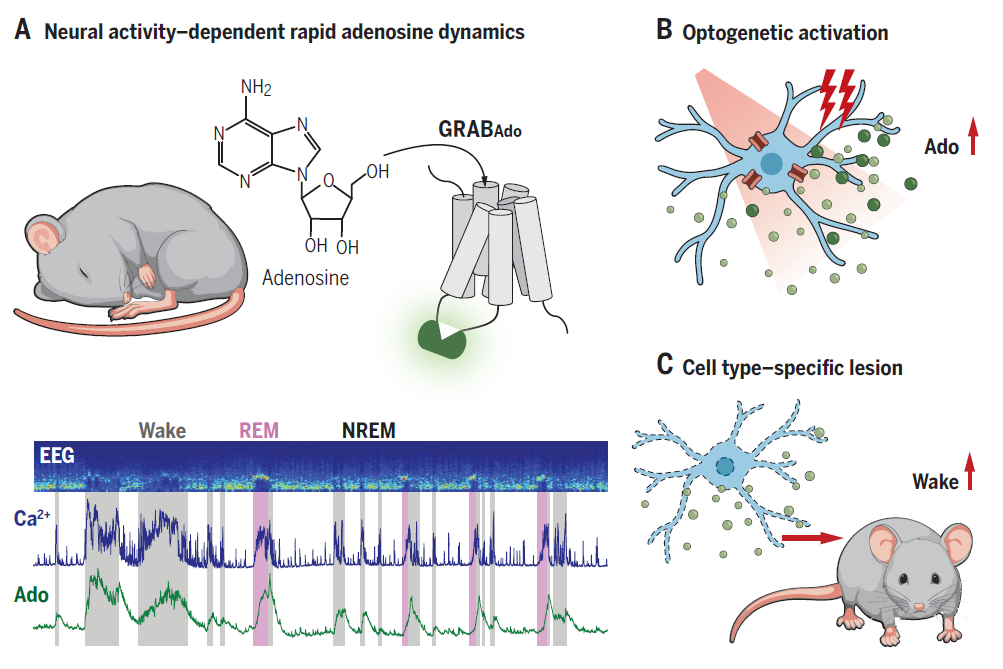
图注:腺苷快速释放和睡眠稳态的神经调控。(A)使用GCaMP和GRABAdo同时记录神经活动和腺苷释放,揭示了睡眠-觉醒周期中小鼠基底前脑区神经活动依赖的快速腺苷释放。(B)光遗传学激活基底前脑区谷氨酸能神经元引起细胞外腺苷的大幅度增加。(C)特异损伤基底前脑区谷氨酸能神经元可降低胞外腺苷水平,并明显增加小鼠的清醒时间。
论文链接:https://science.sciencemag.org/content/369/6508/eabb0556