周专课题组合作《PNAS》在线发表论文
揭示了交感神经递质分泌新机理—细胞膜G蛋白受体的电压敏感性
2020年10月12日,北京大学分子医学研究所、北大-清华生命科学联合中心、生物膜国家重点实验室、北京大学麦戈文脑科学研究所周专教授课题组在美国科学院院报PNAS在线发表题为“Regulating quantal size of neurotransmitter release through a GPCR voltage sensor”的研究论文。
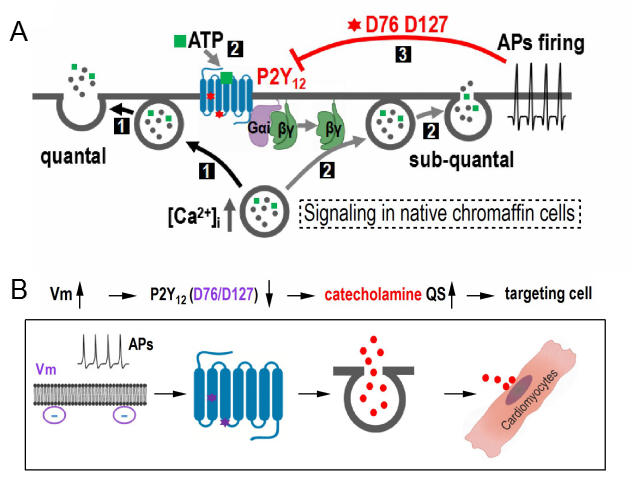
神经细胞通过量子化囊泡分泌实现神经细胞之间信号传导,突触前囊泡分泌的神经递质数量决定突触后信号传导的强度。经典分泌理论认为,动作电位膜上电压门控的离子通道,导致钙离子内流,再由钙触发囊泡中的神经递质分泌。神经细胞膜上已经知道的电压敏感膜蛋白包括离子通道和磷酸酶。本文在哺乳动物交感神经系统细胞膜上发现G蛋白偶联受体(GPCR,它是基因组最大蛋白超家族, 包括P2Y12)也具有膜电压敏感性。交感肾上腺嗜铬细胞的膜电压(细胞膜动作电位)调控P2Y12受体从而调控单个囊泡分泌的肾上腺素分子个数(quantal size)。可见,动作电位(膜电压)不仅可以调控细胞离子通道介导的离子电流及其下游生理信号,而且也能调控GPCR及其下游信号(离子通道,钙信号及其下游信号)。GPCR-P2Y12受体上的电压敏感位点是D76和D127,它们是大多数GPCR家族的保守性位点TM2-DLL和TM3-DRY。对应基因位点的突变降低配体和GPCR的亲和力,抑制P2Y12的激活程度,从而增加了单个囊泡分泌肾上腺素的quantal size ,从而调节下游靶器官心血管系统的生理功能。这项发现将膜电压调控分泌从教科书中的一条通路(离子通道)扩展到二条通路(离子通道和分泌小孔)。该研究提出GPCR对电压敏感的新功能及其分子机理,拓展了领域对GPCR功能的认知,这将对开发以GPCR为靶点的药物研究提供新的视角和思路。
北京大学分子医学研究所博士后张泉峰、刘兵以及博士生李映林担任论文共同第一作者,北京大学周专教授为论文通讯作者。该研究获得科技部国家重点研发计划、国家自然科学基金委、膜生物学国家重点实验室、北大-清华生命科学联合中心等项目支持。
论文链接: https://www.pnas.org/content/117/43/26985