黄卓课题组eLife揭示奎尼丁治疗KCNT1相关癫痫新机制,提出干扰钠钾通道相互作用治疗癫痫新策略
KCNT1基因突变是导致婴幼儿难治性癫痫的重要因素,其编码的Slack通道功能增强可导致婴儿癫痫伴移行性局灶(epilepsy of infancy with migrating focal seizures,EIMFS)、常染色体显性或散发性睡眠相关的高运动性癫痫(autosomal dominant or sporadic sleep-related hypermotor epilepsy,ADSHE)等。
临床上,奎尼丁被广泛用于治疗KCNT1相关癫痫,通过阻断KCNT1编码的Slack通道发挥药效1,2。临床上治疗癫痫的奎尼丁脑脊液浓度为0.05~5.5 μM3,4,然而,奎尼丁在体外抑制Slack通道电流的IC50约为80~125 μM5,6。体内外药物的浓度差异说明奎尼丁治疗KCNT1突变导致癫痫的药理学机制仍不清楚,Slack通道作为单一药物治疗靶点的传统观点需要重新评估。
2023年5月31日,北京大学药学院、IDG麦戈文脑科学研究所黄卓团队,在《eLife》期刊在线发表了题为“Coupling of Slack and Nav1.6 sensitizes Slack to quinidine blockade and guides anti-seizure strategy development”的研究成果,发现电压门控钠离子通道Nav1.6和钠离子激活的钾离子通道Slack之间的功能和物理耦连,两通道耦连显著增强了Slack对奎尼丁阻断的敏感性(IC50从85.13 μΜ至0.87 μΜ)。在此基础上,研究者开发了干扰通道相互作用的策略来治疗Slack突变相关癫痫。

黄卓课题组发现,Slack通道和Nav1.6通道共定位于神经元轴突起始段,两通道在小鼠脑组织和体外活细胞中都发生物理相互作用。Nav1.6通道的表达显著增加Slack通道对奎尼丁阻断的敏感性(图1)。使用河豚毒素(tetrodotoxin,TTX)阻断Nav1.6介导的钠离子内流,可以部分消除Nav1.6介导的增敏效应,说明奎尼丁敏感性增加依赖于Nav1.6钠电流。Slack通道和Nav1.6通道之间的相互作用是这种增敏效应的前提,通过Slack通道C末端和Nav1.6通道N、C末端的物理相互作用来介导(图2)。
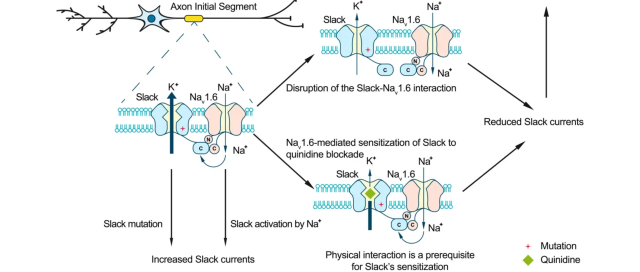
图1:Nav1.6增加Slack对奎尼丁阻断敏感性示意图
此外,研究者基于Slack通道和Nav1.6通道的相互作用开发了新的癫痫治疗策略。在病毒介导过表达癫痫相关Slack突变体的小鼠中,进一步用病毒介导过表达Slack通道C末端,来干扰Slack突变和Nav1.6相互作用,从而降低Slack电流幅值,可以保护小鼠抵抗Slack突变引起的癫痫发作(图2)。
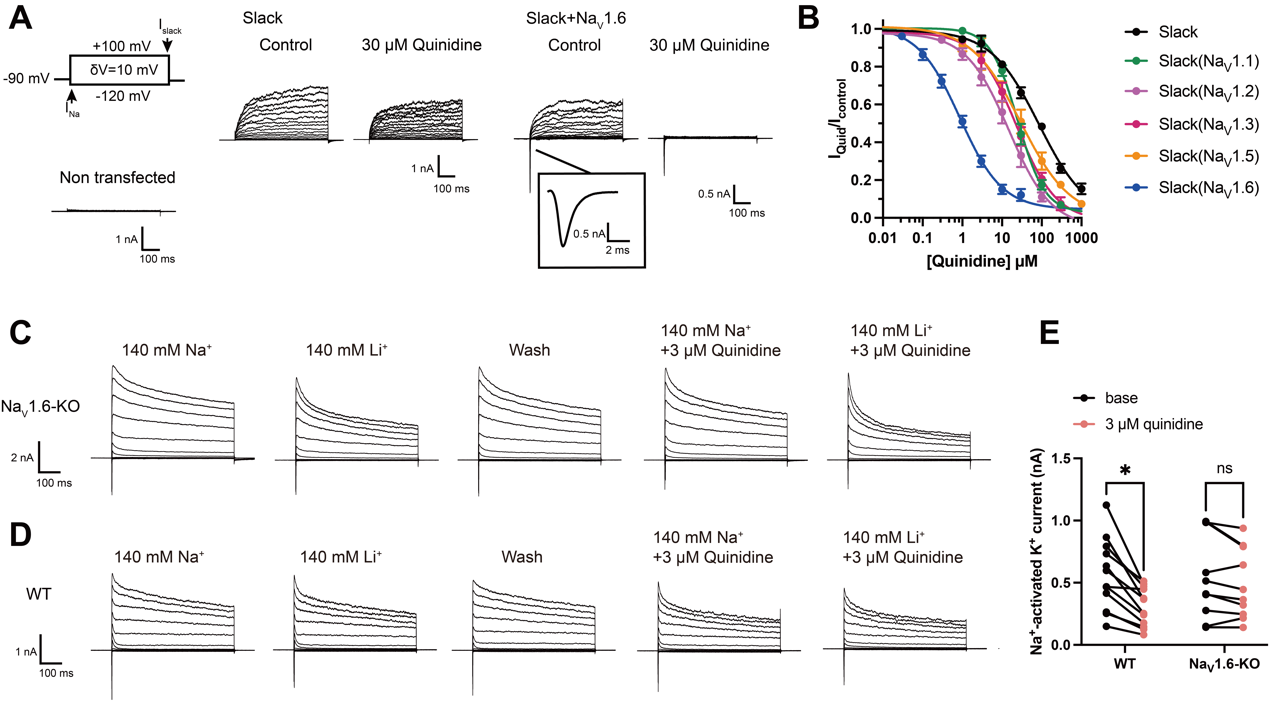
图2:干扰Slack-Nav1.6相互作用和奎尼丁阻断Slack治疗癫痫的模式图
总之,这项研究通过揭示Nav1.6通道与Slack通道之间的功能耦连和物理耦连,为我们重新评估Slack通道作为癫痫治疗单一靶点的传统观点提供了新的视角,并为开发基于通道相互作用的新型抗癫痫治疗策略提供了理论指导。
本文共同第一作者为袁田、王一帆和金雨晨,其他作者为徐帅、张恒(浙江大学)、陈倩和李娜等,通讯作者为黄卓研究员。地址为北京大学药学院分子与细胞药理学系,北大IDG麦戈文脑科学研究所。
原文链接:https://elifesciences.org/reviewed-preprints/87559