黄卓团队Sciences Advances揭示基于“癫痫记忆”的癫痫发病新机制并在临床转化方面取得进展面取得进展
癫痫是一种严重的、反复发作的慢性神经系统疾病,传统理论认为癫痫发作与脑内“兴奋-抑制失衡”理论有关,基于该理论研发的抗癫痫药物也到达近30种,但始终有约1/3的癫痫患者对已有的抗癫痫药物反应不佳,称为药物难治性癫痫【1, 2】。药物难治一直是癫痫领域的巨大挑战,这一现状说明基于“兴奋-抑制失衡”的癫痫发病机制研究策略有待进一步丰富。因此,探索难治性癫痫的发病新机制、新理论,并据此开发安全有效的抗癫痫药物及新的治疗策略具有重要的临床和社会意义。
2024年3月20日,北京大学药学院、IDG麦戈文脑科学研究所、天然药物及仿生药物国家重点实验室黄卓教授团队与合作团队在Science Advances发表了题为“Termination of convulsion seizures by destabilizing and perturbing seizure memory engrams” 的研究论文。这项研究通过构建全新感觉诱发癫痫动物模型,创新性地提出了从“癫痫记忆”的角度研究并治疗癫痫的新思路,是对当前癫痫发病机制的系统性丰富与补充。

目前学界对于癫痫的主流研究思路集中于大脑的“兴奋-抑制失衡”,然而在过去的半个世纪中,却有部分学者却关注到了癫痫与记忆的相似性:Goddard和Douglas认为“在电点燃癫痫模型中,可能存在癫痫印迹细胞(epileptic engram cells)【3】”;Beenhakker团队也曾假设癫痫发生过程可能“劫持”了正常学习记忆的功能环路【4】;类似的,Hsu团队也通过计算和建模的方式假设癫痫的产生是一种异常的学习过程【5】。
为了验证上述假设,研究人员首先借鉴经典的关联记忆范式,构建了感觉信号诱发癫痫发作的全新癫痫动物模型(条件癫痫记忆模型,Conditioned Seizure Memory(CSM) paradigm)。在此模型训练阶段,使用药物诱导癫痫发作的同时给予小鼠气味或声音进行关联;随后在癫痫的发作期,给予小鼠配对过的感觉信号可特异性诱导小鼠癫痫发作,且该诱导发作具有可重复和稳定的特征。以上结果说明癫痫可以与感觉信息相关联,表现出与记忆类似的存储特性,称为“癫痫记忆”。
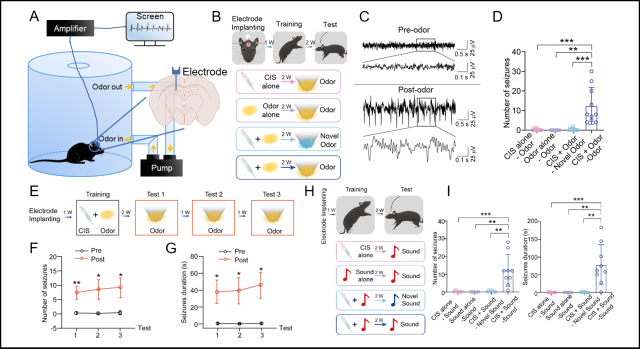
图1 构建条件癫痫记忆模型并验证其有效性与普适性
为进一步验证“癫痫记忆”的可靠性,研究人员运用印迹细胞 (Engram cell)研究范式对条件癫痫记忆模型进行了拓展与验证。在训练阶段,用印迹细胞的化学遗传学操纵代替实体的感觉刺激与癫痫配对;随后在测试阶段,仍然可用感觉信号诱导出稳定的癫痫发作。该部分内容将“癫痫记忆”的机制理解推进至细胞层面,证明了海马脑区“癫痫记忆”印迹细胞的存在。
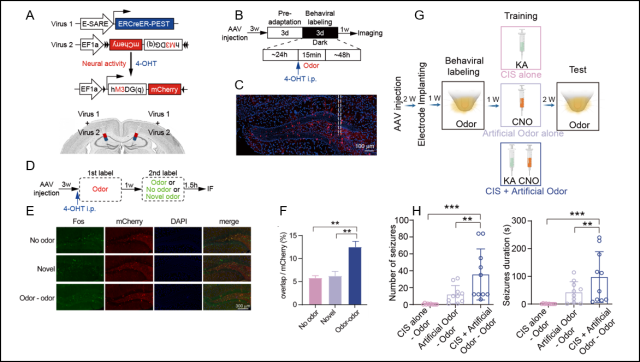
图2 “癫痫记忆”印迹细胞标记与操纵
学习记忆领域的研究表明,在每一次记忆提取后的几分钟至几小时时间窗内,会经历伴随着蛋白合成的再巩固过程【6, 7】,而许多记忆相关的关键蛋白,如BDNF【8】,EGR1【9】, mTOR【10】,ERK等【11】,都可能参与其中,表现出时间依赖性的动态变化。
为了探究“癫痫记忆”是否存在与此类似的分子机制并开发其治疗潜力,研究人员对条件癫痫记忆模型测试阶段的蛋白变化进行了研究。蛋白定量结果显示,在信号特异性诱导癫痫发作后,小鼠背侧海马BDNF、pERK和pmTOR的表达水平均表现出时间依赖性的动态变化。而采用茴香霉素(广谱蛋白酶抑制剂)阻断蛋白合成可破坏再巩固过程,从而缓解信号诱导的癫痫发作。以上结果说明癫痫记忆存在蛋白合成依赖的再巩固过程,该过程能够成为癫痫干预的关键时间窗。

图3 感觉信号诱导的癫痫发作存在蛋白合成依赖的再巩固过程
最后,为了进一步拓展“癫痫记忆”理论的治疗应用,研究人员采用更精准的药理学抑制剂开展了动物和临床实验。在动物实验中,研究人员在“癫痫记忆”再巩固时间窗内(5min)分别抑制mTOR、ERK、BDNF通路均可显著减少后续诱导癫痫发作,而再巩固时间窗外(9h)的干预则无显著效果。与此类似的,在临床实验水平,在病人癫痫发作后立即给予mTOR通路抑制剂依维莫司可显著降低其间期脑电活动(Interictal Epileptiform Discharges, IEDs),显示出可观的癫痫治疗效果。

图4 抑制“癫痫记忆”的再巩固显著缓解癫痫动物与病人的癫痫发作
综上所述,该研究通过构建全新感觉诱发癫痫动物模型,实现了海马脑区的“癫痫记忆”印迹细胞标记与操纵,解析了“癫痫记忆”再巩固过程的分子机制,证明了“癫痫记忆”存在与学习记忆过程类似的再巩固过程,mTOR、ERK和BDNF通路参与其中,并通过抑制该再巩固过程显著减弱了动物癫痫发作;此外,该研究还实现了临床转化,在难治性癫痫病人中使用mTOR通路抑制剂依维莫司可显著减轻癫痫的症状。
该研究提出的“癫痫记忆”研究思路是对传统癫痫理论的系统性丰富,所提出的癫痫发病机制解释与干预再巩固过程的治疗策略有望成为治疗难治性癫痫的突破口,引领癫痫研究的新方向。
本文共同第一作者为赖世荣、张力博、涂心宇、马昕玥。中国医科大学附属盛京医院马维宁和李少一主任、北京大学基础医学院时杰和薛言学教授、北京大学药学院黄卓教授为论文通讯作者。
参考文献
1. R. D. Thijs, R. Surges, T. J. O'Brien, J. W. Sander, Epilepsy in adults. Lancet 393, 689-701 (2019).
2. Y. Wang, Z. Chen, An update for epilepsy research and antiepileptic drug development: Toward precise circuit therapy. Pharmacol Ther 201, 77-93 (2019).
3. G. V. Goddard, R. M. Douglas, Does the engram of kindling model the engram of normal long term memory? Can J Neurol Sci 2, 385-394 (1975).
4. M. P. Beenhakker, J. R. Huguenard, Neurons that fire together also conspire together: is normal sleep circuitry hijacked to generate epilepsy? Neuron 62, 612-632 (2009).
5. D. Hsu, W. Chen, M. Hsu, J. M. Beggs, An open hypothesis: is epilepsy learned, and can it be unlearned? Epilepsy Behav 13, 511-522 (2008).
6. K. Nader, G. E. Schafe, J. E. Le Doux, Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval. Nature 406, 722-726 (2000).
7. 23. N. C. Tronson, J. R. Taylor, Molecular mechanisms of memory reconsolidation. Nat Rev Neurosci 8, 262-275 (2007).
8. M. C. Gonzalez, A. Radiske, M. Cammarota, On the involvement of BDNF signaling in memory reconsolidation. Front Cell Neurosci 13, 383 (2019).
9. M. C. Gonzalez, J. I. Rossato, A. Radiske, M. Pádua Reis, M. Cammarota, Recognition memory reconsolidation requires hippocampal Zif268. Sci Rep 9, 16620 (2019)
10. C. A. Hoeffer, E. Klann, mTOR signaling: at the crossroads of plasticity, memory and disease. Trends in neurosciences 33, 67-75 (2010).
11. C. M. Atkins, J. C. Selcher, J. J. Petraitis, J. M. Trzaskos, J. D. Sweatt, The MAPK cascade is required for mammalian associative learning. Nat Neurosci 1, 602-609 (1998).