于佳宁课题组揭示背外侧纹状体在等待中的作用
前言
2011年,在韩国大邱举行的世界田径锦标赛上,号称闪电的牙买加短跑运动员博尔特因为“抢跑”而被罚下。这个经验丰富的运动员,在关键时刻,为什么不能“耐心”地等待发令枪的指示?事实上,很多日常行为或者实验室设计的行为中,都有“等待”或者“延迟”的成分。然而,我们并不知道动物如何学习等待,哪些脑区在等待过程中至关重要,在需要快速反应的行为中,大脑又是如何优化等待和反应速度之间的平衡?
2025年2月14日,北京大学生命科学学院、IDG麦戈文脑科学研究所于佳宁课题组,在《Journal of Neuroscience》发表的一项研究表明,大脑中的背外侧纹状体对等待行为至关重要。实验室通过对大鼠的行为分析、特定脑区损伤和电生理记录,发现损伤背外侧纹状体(图 1)会导致动物难以等待,即更容易提前行动。

图 1. 背外侧纹状体损伤
文章信息及链接:Zheng, Qiang†, Yujing Liu†, Yue Huang, Jiaming Cao, Xuanning Wang, and Jianing Yu✉. “The Role of Striatum in Controlling Waiting during Reactive and Self-Timed Behaviors.” The Journal of Neuroscience, February 14, 2025, e1820242025.
https://doi.org/10.1523/JNEUROSCI.1820-24.2025.
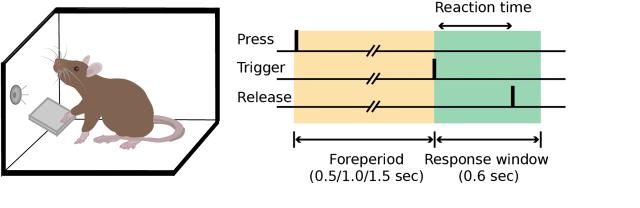
图 2. 大鼠简单反应时间任务
在这个研究中,我们训练大鼠进行简单反应时间任务,要求它们按住杠杆,等待信号后再松开杠杆以获得奖励[1](图 2)。然后,在熟练掌握该任务的大鼠脑内的不同脑区进行定位损伤[2],以观察这些脑区在任务中的作用。在这项工作里,我们共准备了四组大鼠进行损伤实验,分别定位于单侧的运动皮层或者背外侧纹状体,或是双侧的运动皮层或背外侧纹状体。所有的损伤都造成了动物行为表现的下降(即,没有因为学习后,某个脑区不再参与),但经过短时间(一周内)的复训,不同损伤组的动物有不同程度的恢复,其中值得特别注意的是,双侧背外侧纹状体损伤造成了动物长期的等待缺陷(图3),即,损伤后的动物难以维持等待,在制约信号发生前产生行动(过早反应,错误模式的一种)的概率持续增加,且这种错误模式不会因为长期训练得到改善。相比而言,运动皮层损伤的动物有少量的反应时间延长的持续障碍,但总体而言可以恢复到接近损伤前的水平(图3)。

图 3. 双侧运动皮层或背外侧纹状体损伤对简单反应时间任务行为的影响
进一步,我们训练了一批动物进行自发计时(self-timing)的行为:这些动物需要在没有外界信号指导的情况下,将反应时间控制在1秒(或1.5秒)之后。通过双侧纹状体损伤,自发计时的动物出现了持续的反应时间分布的左移,这与简单反应时间任务中损伤造成的障碍有相似之处。进一步的实验表明,让持续反应左移的大鼠进行更长时间的按杆(1 → 1.5秒),这些动物也可以学会增加按杆的时长,似乎可以说明它们并不是因为运动障碍导致不能长期维持按杆从而产生上述行为上的改变。
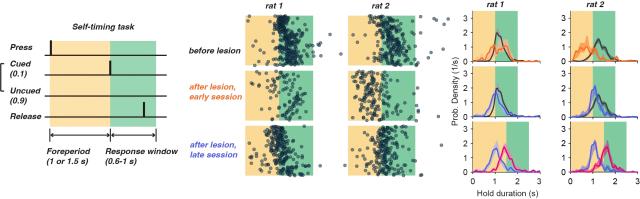
图 4. 双侧背外侧纹状体损伤造成自发运动计时分布的左移, 然而当延时增加后,运动计时也随之增加
总体看来,这些结果说明,无论是依赖外界信号还是内部策划的运动输出,都会因纹状体损伤,出现延迟上的缺陷。综合历史上的一些文献看来,基底节的一些核团(如丘脑下核团)或者神经递质—如多巴胺—缺陷,会导致长期的等待缺陷,因此基底节应该是研究延迟行为的重要脑网络,值得进一步深入研究[3]。
尽管双侧纹状体损伤造成了等待的障碍,通过机体动力学分析,我们发现损伤后的动物运动能力有持续的下降,体现为全身运动速度和上肢运动速度的下降,这与领域内一些看法是一致的,即纹状体促进了运动的活力(vigor)[4]。我们的工作中表明运动活力的下降和等待能力的降低是会同时发生的。
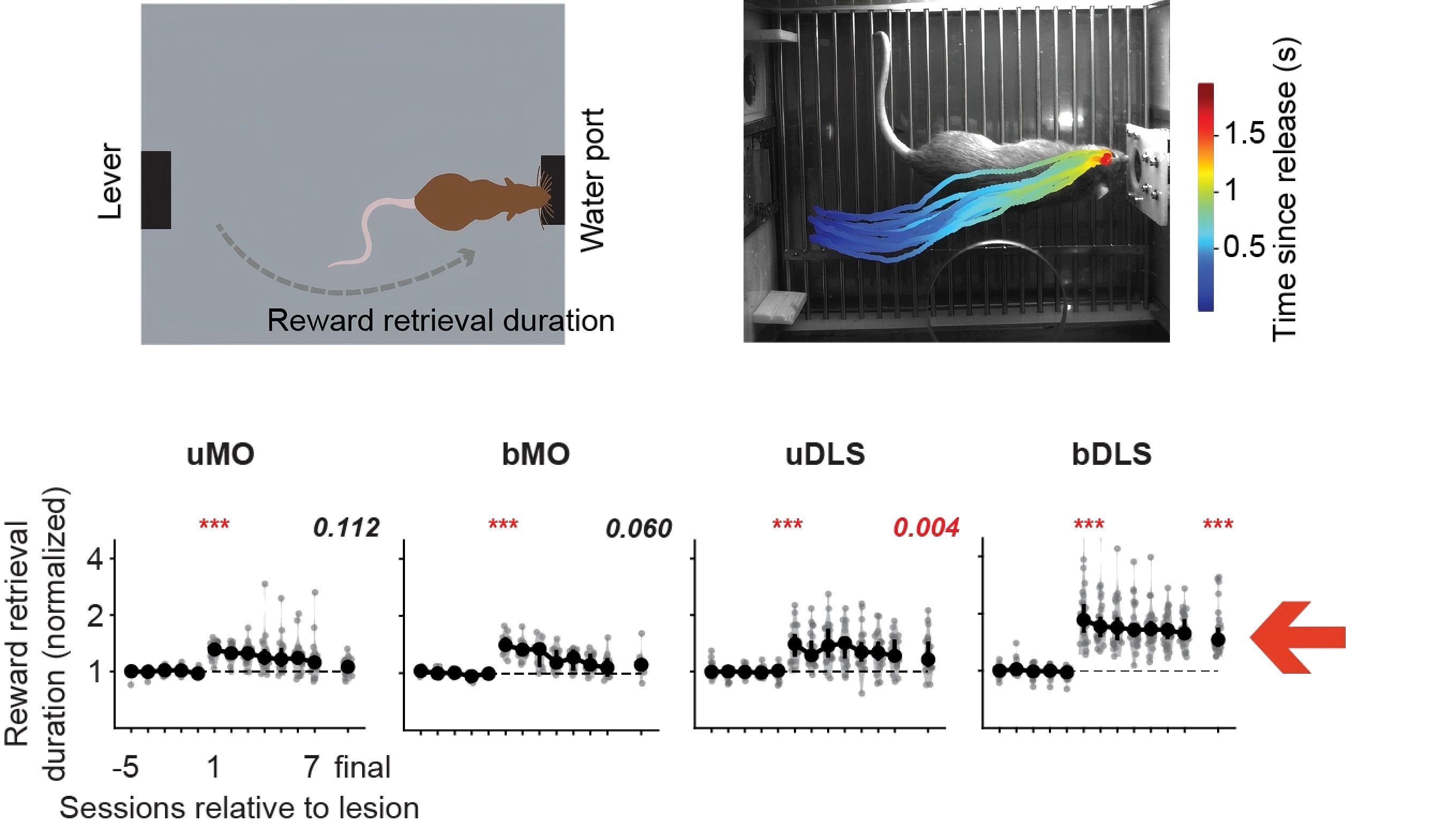
图 5. 双侧背外侧纹状体损伤造成持久的全身位移运动变慢,其他损伤组对位移运动的影响较轻
在这项工作中,我们也汇报了基于慢性电生理记录观察到的皮层和纹状体神经元在行为中的放电模式,且这两个脑区的放电有较强的相似性。这些放电与动物行为的不同组分有关(如接近按杆,抬手,趋向奖励等)。事实上,当动物进行熟练的行为操作时,尤其是基于试次(trial)的结构,很多脑区都会呈现类似的放电序列,然而不同脑区对行为的贡献,则需要对这些脑区进行干扰,才可能洞察到一些线索。
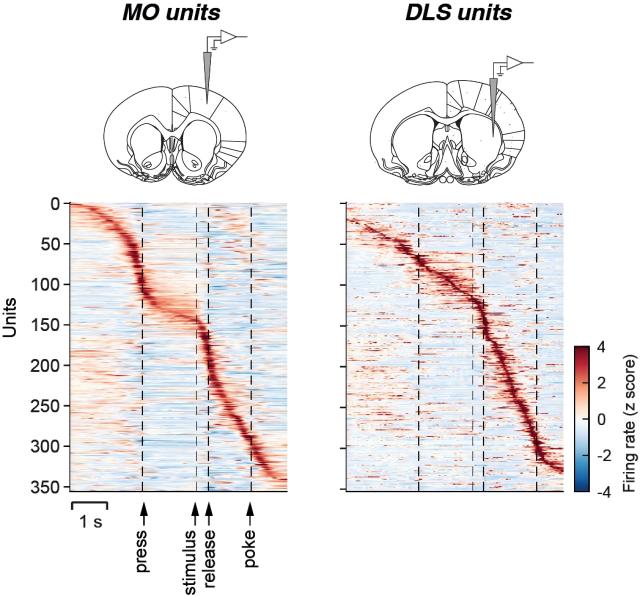
图 6. 简单反应时间任务中,运动皮层与纹状体神经元的放电有一定相似性
展望
为什么背外侧纹状体对等待如此关键?目前仍没有明确答案。为回答这个问题,或许,在任务学习的过程中,通过慢性长期记录并跟踪大量神经元的放电活动与行为指标进步之间的关系,可能对认识纹状体的功能有更大的启发,另外,损伤后的大脑网络其他成员的活动变化也是值得系统研究的。这些是实验室目前正在进行及未来筹划开展的工作,我们期望这些工作对于理解基底神经节如何控制运动输出和认知功能,以及其病变如何导致神经系统疾病(如帕金森氏症),是有重要价值的。
贡献与致谢
本研究由博士研究生郑强,刘予婧合作完成,博士研究生黄越,曹嘉明和王宣宁贡献了重要的实验数据和分析。实验室受到北大-清华生命科学联合中心和北大IDG麦戈文脑科学研究所的资助。本研究也获得以下资助:北京大学膜生物学重点实验室、国家自然科学基金面上项目(32271052)、北京市自然科学基金面上项目(5212007)、北京脑科学与类脑研究所。
脚注
[1] 该行为范式最初由法国科学家Marianne Amalric开发,后来被美国科学家Mark Laubach应用于研究运动学习和抑制控制。Mark Laubach将动物训练程序分享给我们实验室,帮助我们建立了该行为范式,并提供了很多有价值的信息和讨论。
Amalric, M, and Gf Koob. “Depletion of Dopamine in the Caudate Nucleus but Not in Nucleus Accumbens Impairs Reaction-Time Performance in Rats.” The Journal of Neuroscience 7, no. 7 (July 1, 1987): 2129–34. https://doi.org/10.1523/JNEUROSCI.07-07-02129.1987.
Laubach, M., J. Wessberg, and M. A. Nicolelis. “Cortical Ensemble Activity Increasingly Predicts Behaviour Outcomes during Learning of a Motor Task.” Nature 405, no. 6786 (June 1, 2000): 567–71. https://doi.org/10.1038/35014604.
Narayanan, Nandakumar S., and Mark Laubach. “Top-Down Control of Motor Cortex Ensembles by Dorsomedial Prefrontal Cortex.” Neuron 52, no. 5 (December 2006): 921–31. https://doi.org/10.1016/j.neuron.2006.10.021.
[2] 损伤是行为神经科学的重要途径,可以揭示指定脑区不可替代的功能。本文使用的方法是通过激活谷氨酸受体导致神经元过度兴奋后的神经毒性死亡(excitotoxic cell deaths)。虽然实验室也在进行光遗传学及化学遗传学的实验,但在我们看来,损伤是不可忽视的实验手段。事实上,不同时间尺度的干扰实验可能会得到不同的结论,因此对任何脑区的功能性研究,理想情况下,要通过搜集不同时间尺度干扰的结果(如Thomas Südhof在下文中倡导的那样),才可能得到有价值的结论。
Südhof, Thomas C. “Experimental Mismatch in Neural Circuits.” Nature 528, no. 7582 (December 2015): 338–39. https://doi.org/10.1038/nature16323.
[3] Amalric, M., H. Moukhles, A. Nieoullon, and A. Daszuta. “Complex Deficits on Reaction Time Performance Following Bilateral Intrastriatal 6-OHDA Infusion in the Rat.” European Journal of Neuroscience 7, no. 5 (May 1995): 972–80. https://doi.org/10.1111/j.1460-9568.1995.tb01085.x.
Baunez, C., A. Nieoullon, and M. Amalric. “In a Rat Model of Parkinsonism, Lesions of the Subthalamic Nucleus Reverse Increases of Reaction Time but Induce a Dramatic Premature Responding Deficit.” The Journal of Neuroscience: The Official Journal of the Society for Neuroscience 15, no. 10 (October 1995): 6531–41.
[4] Dudman, Joshua T, and John W Krakauer. “The Basal Ganglia: From Motor Commands to the Control of Vigor.” Current Opinion in Neurobiology 37 (April 2016): 158–66. https://doi.org/10.1016/j.conb.2016.02.005.
Jurado-Parras, Maria-Teresa, Mostafa Safaie, Stefania Sarno, Jordane Louis, Corane Karoutchi, Bastien Berret, and David Robbe. “The Dorsal Striatum Energizes Motor Routines.” Current Biology 30, no. 22 (November 2020): 4362-4372.e6. https://doi.org/10.1016/j.cub.2020.08.049.
Panigrahi, Babita, Kathleen A. Martin, Yi Li, Austin R. Graves, Alison Vollmer, Lars Olson, Brett D. Mensh, Alla Y. Karpova, and Joshua T. Dudman. “Dopamine Is Required for the Neural Representation and Control of Movement Vigor.” Cell 162, no. 6 (September 10, 2015): 1418–30. https://doi.org/10.1016/j.cell.2015.08.014.
Desmurget, M., and R. S. Turner. “Motor Sequences and the Basal Ganglia: Kinematics, Not Habits.” Journal of Neuroscience 30, no. 22 (June 2, 2010): 7685–90. https://doi.org/10.1523/JNEUROSCI.0163-10.2010.
———. “Testing Basal Ganglia Motor Functions Through Reversible Inactivations in the Posterior Internal Globus Pallidus.” Journal of Neurophysiology 99, no. 3 (March 1, 2008): 1057–76. https://doi.org/10.1152/jn.01010.2007.
Turner, Robert S, and Michel Desmurget. “Basal Ganglia Contributions to Motor Control: A Vigorous Tutor.” Current Opinion in Neurobiology 20, no. 6 (December 2010): 704–16. https://doi.org/10.1016/j.conb.2010.08.022.